中华医学会
地址: 中国北京东四西大街42号
邮编: 100710
MAGEL2基因变异致新生儿Schaaf-Yang 综合征一例
本文引用格式:黄钟文, 杨琳, 吴冰冰, 等. MAGEL2基因变异致新生儿Schaaf-Yang 综合征一例 [J] . 中华围产医学杂志, 2021, 24(11) : 858-861. DOI: 10.3760/cma.j.cn113903-20210312-00209.
摘要
本文报道了1例新生儿期发病的Schaaf-Yang综合征(Schaaf-Yang syndrome, SYS)病例。患儿,女,第2胎第2产,出生时缺氧窒息,生后持续严重呼吸困难,入院诊断为窒息、脑病、先天性心脏病、肺炎、败血症、黄疸、先天性喉软骨发育不全、声带麻痹。转入新生儿重症监护病房予呼吸支持、营养支持及抗感染治疗1个月,患儿家长要求出院。经随访,患儿于2月龄时因呼吸衰竭死亡。本例家系全外显子组测序结果提示,患儿MAGEL2基因存在c.1912C>T(p.Q638X)杂合无义致病变异,变异来源于父亲,母亲未见此变异。
【关键词】 呼吸功能不全;肌张力过低;智力障碍;神经发育障碍;蛋白质类;变异;全外显子组测序;婴儿,新生
患儿女,第2胎第2产,胎龄39周+3经阴道分娩出生,体重3 800 g,1和5 min Apgar评分分别为7和8分,皮肤青紫,肌张力低下,反应差,予清理呼吸道、吸氧处理后皮肤青紫减轻,反应仍差,刺激后不哭;羊水浑浊、量正常,胎盘、脐带未见异常。当地医院住院治疗给予头孢噻肟钠(凯福隆)抗感染,吸氧,补液,予果糖营养心肌,神经节苷酯营养脑细胞,血气分析提示二氧化碳分压逐渐增高,61~79 mmHg(1 mmHg=0.133 kPa)。生后4 d因“新生儿窒息”收入复旦大学附属儿科医院新生儿重症监护病房(neonatal intensive care unit, NICU)。患儿父母体健,非近亲结婚,母亲自然受孕,定期产前检查,孕29周B超示胎儿水肿,否认孕期其他并发症/合并症。患儿母亲第1胎出生后有相似表现,新生儿期死亡,无具体病史,当时疑诊为“猫叫综合征”。
入院体格检查:患儿意识不清,精神反应差,外貌异常,高腭弓,头颅圆,前囟平,大小1.5 cm×1.5 cm,颅缝平软;头围36 cm,身长46 cm,体重3 690 g,皮肤黏膜轻度黄染,无皮疹,无水肿,无出血点。口唇尚红,无青紫,呼吸急促65次/min,三凹征阳性,双肺呼吸音粗,未闻及明显啰音;心音有力,律齐,130次/min,可闻及2级收缩期杂音,腹部隆起,未及包块,肠鸣音正常,腹股沟未及包块。乳晕和外阴颜色较深。四肢无活动,双手指关节屈曲、伸展受限,双手贯通掌,肌力及肌张力差,拥抱反射、吸吮反射、握持反射未引出。
入院血气分析:pH值 7.594,氧分压279.9 mmHg, 二氧化碳分压242.6 mmHg,碳酸氢根41.6 mmol/L,碱剩余17.6 mmol/L;血常规:白细胞计数21.8×109/L、中性粒细胞百分比52.4%;血液生化检查:总胆红素109.2 µmol/L,直接胆红素13.8 µmol/L,血氨166 µmol/L,余未见异常;凝血功能:D-二聚体2.28 mg/L,凝血酶原时间18.3 s;甲状腺功能未见异常;听力筛查示双耳听力轻度丧失。
生后1 d外院心脏超声检查示:房间隔缺损(继发孔型),约0.41 cm;二尖瓣、三尖瓣反流;肺动脉高压(压差36 mmHg);左右肺动脉血流速度稍快。本院胸部X射线检查示:两肺纹理增多、粗;右膈面局部较左膈面抬高2个肋单元。头颅CT示:枕顶部颅骨内板下、小脑幕边缘及前后纵裂池可见条带状高密度影,双侧额部脑外间隙稍宽。头颅MRI示:左侧侧脑室前角较对侧宽,顶枕部T1加权成像为条状高信号,诊断为“硬膜下出血”。头颅B超示:左侧颅内出血Ⅱ级,右侧脉络丛形态毛糙,双侧脑室不对称,囟门小,双侧颞叶探测不清,大脑中动脉阻力指数增高。腹部彩超未见异常。
患儿收入NICU后病情危急告知家属;同时心电血氧监护;鼻饲喂养,补液支持;自主呼吸较弱,气管插管呼吸机常频治疗,经皮血氧饱和度维持正常;入院2 d后改为鼻导管低流量吸氧,予注射氨苄西林钠舒巴坦钠(优立新)联合凯福隆抗感染治疗5 d,血氧稳定,呼吸规律,气道分泌物减少,病情好转,调整为优立新联合头孢他定(复达欣)抗感染治疗3 d。入院第10天请心内科会诊,加用呋塞米(速尿)、安体舒通利尿减轻心肺负荷。第14天无明显诱因出现血氧饱和度下降,未吸氧时波动于80%~90%,予吸痰,吸痰时血氧饱和度最低降至50%,当时患儿面部青紫,四肢稍凉,意识不清,精神萎靡,予拍背刺激1 min后逐渐缓解,离氧不耐受;结合心肌酶谱异常,加用注射用磷酸肌酸钠营养心肌,予康复治疗,加强气道护理。第16天患儿体温仍有波动,加用复达欣抗感染;体格检查示:胸骨上窝吸气性凹陷,闻及喉喘鸣音,双肺呼吸音粗,可闻及少量啰音;雾化吸痰每4小时1次,可吸出中等量白色黏痰。第18天患儿病情加重,反复发热(热峰39.4 ℃),再次通知家属病危,停复达欣,加用美罗培南抗感染,体温下降。痰培养结果示:泛耐药肺炎克雷伯杆菌、铜绿假单胞菌。住院治疗1个月后,患儿体温正常,鼻饲80 ml,每3小时1次能完成,患儿家长要求出院,告知家长目前治疗未结束,现出院病情可能加重,家长坚持出院。后随访得知患儿于2月龄时因呼吸衰竭死亡。
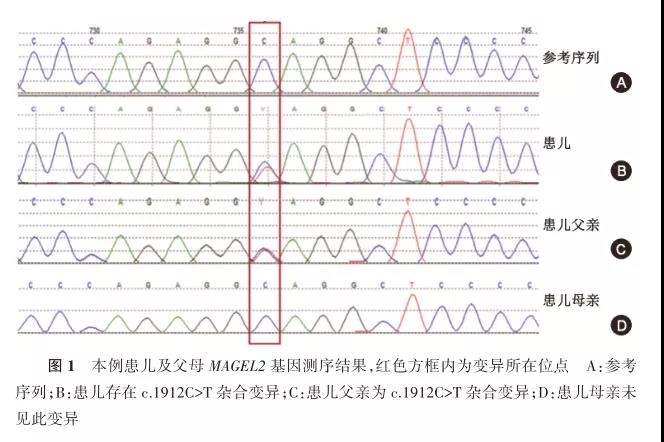
经患儿父母知情同意和本院伦理委员会批准(批号:2015-130),行全外显子组测序,检测到MAGEL2基因的1个已报道致病的杂合无义变异c.1912C>T(p.Q638X)。经Sanger测序验证,该变异来源于患儿父亲,母亲未见此变异(图1)。生物信息学分析显示该变异可导致第638位氨基酸提前产生终止密码子,形成截短蛋白。
讨论
Schaaf-Yang综合征[(Schaaf-Yang syndrome, SYS),在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man, OMIM):615547]是一种罕见的印记基因相关的神经发育性遗传病,最早于2013年由Schaaf等[1]报道,主要由于MAGEL2基因发生截短变异导致功能丧失所致,呈常染色体显性遗传,以新生儿肌张力低下、喂养困难、发育迟缓/智力障碍、关节挛缩和自闭症谱系障碍为特征[2]。截至2021年4月,经文献检索发现全球共报道112例SYS患者,包括中国报道的12例(10.7%)[3-7]。在已报道的112例中,110例为截短变异,1例错义变异,1例插入缺失变异。
1.遗传病因及遗传模式:MAGEL2基因(OMIM:605283)位于Prader-Willi综合征(Prader-Willi syndrome, PWS)关键区域15号染色体q11-q13,编码黑色素瘤相关抗原(melanoma-associated antigen, MAGE)家族最大的蛋白MAGEL2。MAGEL2作为一种泛素连接酶增强剂,通过MAGE同源结构域(MAGE homology domain, MHD)结合E3泛素连接酶——三结构域蛋白27(tripartite motif protein 27, TRIM27),与泛素特异性蛋白酶7(ubiquitin-specific protease 7, USP7)形成MAGEL2-USP7-TRIM27复合体,通过泛素化调控蛋白质从细胞内体逆行运输到高尔基体这一重要的细胞过程,促进多种蛋白质的循环利用,在调节细胞周期、受体循环、神经元信号转导及神经轴突生长等过程中发挥重要作用[8-9]。胚胎期MAGEL2在神经系统广泛表达,在一些非神经系统的器官和组织(如肾脏、肺、肢芽、口腔)中也有表达;出生后MAGEL2 mRNA表达局限于在大脑的特定区域,尤其是下丘脑视交叉上核和室旁核[10-13]。由于MAGEL2母源印记区域被甲基化而沉默,仅由未甲基化的父源等位基因表达[10-11]。这种印记特点决定了SYS与经典常染色体显性遗传模式不同,MAGEL2父源等位基因发生杂合致病变异的个体,无论其性别,外显率被认为是100%;而母源等位基因变异的个体不受影响。已报道的病例中,约50%患儿的致病变异来自父亲,其余为新发变异。
2.临床表现:经查阅文献,c.1912C>T(p.Q638X)变异包括本例共报道了6例[14-17],这些患儿的共同特征是出生后不久均出现哭声无力、喂养困难、肌张力低下、指间关节畸形、呼吸衰竭(需要呼吸机辅助通气)、颅面畸形及生长发育明显迟缓。2017年日本报道了一对姐弟[14],发育均明显滞后,女孩的面部畸形包括杏仁状睑裂、鼻根凹陷、中颌骨扁平、小颌,1岁时头颅MRI显示脑白质萎缩,3岁时因反复吸入性肺炎行胃造口术;而男孩出现高腭弓、小颌、小阴茎和隐睾,且存在特发性中枢性尿崩症(头颅MRI示脑垂体正常),偶有癫痫发作。另一患儿在新生儿期出现呼吸抑制,肌张力减退,有进食困难和吞咽困难,手指和脚趾挛缩,双侧马蹄内翻足,出生1个月时曾出现心脏骤停、呼吸暂停和心动过缓等[15]。由于头颅三角畸形,在2岁时接受神经外科手术。该患儿生长发育明显滞后,11岁才能辅助行走,有严重的智力残疾,无语言表达能力;此外,还伴有睡眠障碍、体温不稳定、性腺功能异常等下丘脑内分泌功能紊乱等。本例患儿在新生儿期存在肌张力低下、喂养困难、呼吸衰竭及手指关节挛缩,符合SYS的经典表型。另外,本例患儿伴有多种出生缺陷如先天性心脏病、先天性喉软骨发育不全、声带麻痹、先天性膈膨升等,由于严重的呼吸系统并发症,于2月龄时死亡。患儿母亲的第1胎出生后有相似表现,亦未存活,当时疑诊“猫叫综合征”,但未进行遗传检测,病因未知。
3.诊断:目前尚无SYS临床诊断标准,明确诊断依赖于基因检测。但对于有以下临床表型和实验室检查提示的患者,应怀疑存在SYS可能[1]。临床表型包括:(1)婴儿期广泛肌张力低下;(2)婴儿期呼吸窘迫;(3)婴儿期喂养困难;(4)儿童期或青少年期食欲过盛导致肥胖;(5)中重度发育迟缓/智力障碍;(6)自闭症谱系障碍;(7)非特异性面部畸形特征,如小颌畸形、前额突出、耳位低;(8)身材矮小;(9)不同程度的关节挛缩,如轻度的远端指间关节挛缩和严重的多发性先天性关节炎;(10)内分泌异常,包括垂体功能低下、生长激素缺乏、男性性腺功能低下等。实验室检查:(1)15q11.2区域( Prader-Willi/Angelman综合征位点)甲基化分析正常;(2)出现以下任何激素或代谢异常结果:尽管体重正常、营养充足,但胰岛素样生长因子-1水平较低;口服葡萄糖耐量试验结果示有血糖水平升高;空腹胃饥饿激素(生长激素释放肽)水平升高。
当表型和实验室检查结果提示SYS时,分子遗传学检测方法可以采用靶向单基因检测或多基因检测,如果检测到MAGEL2致病变异,则应通过亲本检测或对先证者甲基化敏感性测序来确定变异等位基因的亲本来源。而当表型难以与以婴儿期肌张力低下和/或智力障碍为特征的许多其他遗传性疾病区分时,可以考虑进行全外显子组测序。
4.治疗及预后:SYS的病死率高(17.7%),在目前国内外报道的113例(包括本例)中,有20例死亡[5-7,17-19]。胎儿期死亡的平均孕龄为24周,主要死亡原因为严重的多发性先天性关节炎;生后患儿死亡的平均年龄为1月龄,主要死因为呼吸衰竭。目前无SYS特效疗法,初步诊断为SYS后,应对患儿的生长发育指标、喂养情况、神经系统、肌肉骨骼系统、内分泌系统、精神行为、泌尿生殖系统及睡眠情况进行全面评估和随访监测,及时对症治疗。
综上,通过本例病例报告,提高儿科医生对SYS的认识。虽然SYS是一种罕见病,但是近年来有越来越多的病例被报道。MAGEL2是母源印记、父源表达的基因,患儿的致病变异来源于没有表型的父亲或新发变异。当孟德尔分析无阳性结果时,需要特别注意印记基因。随着高通量技术的发展,期待基因检测为患者及其家庭提供更佳的遗传咨询指导及产前诊断。
参考文献 [1] Schaaf CP, Gonzalez-Garay ML, Xia F, et al. Truncating mutations of MAGEL2 cause Prader-Willi phenotypes and autism[J]. Nat Genet, 2013,45(11):1405-1408. DOI: 10.1038/ng.2776. [2] McCarthy J, Lupo PJ, Kovar E, et al. Schaaf-Yang syndrome overview: Report of 78 individuals[J]. Am J Med Genet A, 2018,176(12):2564-2574. DOI: 10.1002/ajmg.a.40650. [3] 卫雅蓉, 郭冰冰, 丁扬. Schaaf-Yang综合征1例[J]. 中华实用儿科临床杂志, 2018, 33(20): 1590-1591. DOI:10.3760/cma.j.issn.2095-428X.2018.20.018. Wei YR, Guo BB, Ding Y. Case report of Schaaf-Yang syndrome[J]. Chin J Appl Clin Pediatr, 2018, 33(20): 1590-1591. DOI:10.3760/cma.j.issn.2095-428X.2018.20.018. [4] 陈雪菲, 宋叶梅, 邹朝春. MAGEL2基因新发变异致Schaaf-Yang综合征一例[J]. 中华儿科杂志, 2019, 57(2): 155-157. DOI:10.3760/cma.j.issn.0578-1310.2019.02.020. Chen XF, Song YM, Zou CC. Schaaf-Yang syndrome caused by the new variation of MAGEL2 gene in a case[J]. Chin J Pediatr, 2019, 57(2): 155-157. DOI:10.3760/cma.j.issn.0578-1310.2019. 02.020. [5] Tong W, Wang Y, Lu Y, et al. Whole-exome sequencing helps the diagnosis and treatment in children with neurodevelopmental delay accompanied unexplained dyspnea[J]. Sci Rep, 2018,8(1):5214. DOI: 10.1038/s41598-018-23503-2. [6] Guo W, Nie Y, Yan Z, et al. Genetic testing and PGD for unexplained recurrent fetal malformations with MAGEL2 gene mutation[J]. Sci China Life Sci, 2019,62(7):886-894. DOI: 10.1007/s11427-019-9541-0. [7] Chen X, Ma X, Zou C. Phenotypic spectrum and genetic analysis in the fatal cases of Schaaf-Yang syndrome: Two case reports and literature review[J]. Medicine (Baltimore), 2020,99(29):e20574. DOI: 10.1097/MD.0000000000020574. [8] Doyle JM, Gao J, Wang J, et al. MAGE-RING protein complexes comprise a family of E3 ubiquitin ligases[J]. Mol Cell, 2010,39(6):963-974. DOI: 10.1016/j.molcel.2010.08.029. [9] Tacer KF, Potts PR. Cellular and disease functions of the Prader-Willi syndrome gene MAGEL2[J]. Biochem J, 2017,474(13):2177-2190. DOI: 10.1042/BCJ20160616. [10] Boccaccio I, Glatt-Deeley H, Watrin F, et al. The human MAGEL2 gene and its mouse homologue are paternally expressed and mapped to the Prader-Willi region[J]. Hum Mol Genet, 1999,8(13):2497-2505. DOI: 10.1093/hmg/8.13.2497. [11] Lee S, Kozlov S, Hernandez L, et al. Expression and imprinting of MAGEL2 suggest a role in Prader-willi syndrome and the homologous murine imprinting phenotype[J]. Hum Mol Genet, 2000,9(12):1813-1819. DOI: 10.1093/hmg/9.12.1813. [12] Carias KV, Zoeteman M, Seewald A, et al. A MAGEL2-deubiquitinase complex modulates the ubiquitination of circadian rhythm protein CRY1[J]. PLoS One, 2020,15(4):e0230874. DOI: 10.1371/journal.pone.0230874. [13] Gregory LC, Shah P, Sanner J, et al. Mutations in MAGEL2 and L1CAM are associated with congenital hypopituitarism and arthrogryposis[J]. J Clin Endocrinol Metab, 2019,104(12):5737-5750. DOI: 10.1210/jc.2019-00631. [14] Enya T, Okamoto N, Iba Y, et al. Three patients with Schaaf-Yang syndrome exhibiting arthrogryposis and endocrinological abnormalities[J]. Am J Med Genet A, 2018,176(3):707-711. DOI: 10.1002/ajmg.a.38606. [15] Urreizti R, Cueto-Gonzalez AM, Franco-Valls H, et al. A de novo nonsense mutation in MAGEL2 in a patient initially diagnosed as Opitz-C: similarities between Schaaf-Yang and Opitz-C syndromes[J]. Sci Rep, 2017,7:44138. DOI: 10.1038/srep44138. [16] Negishi Y, Ieda D, Hori I, et al. Schaaf-Yang syndrome shows a Prader-Willi syndrome-like phenotype during infancy[J]. Orphanet J Rare Dis, 2019,14(1):277. DOI: 10.1186/s13023-019-1249-4. [17] Fountain MD, Aten E, Cho MT, et al. The phenotypic spectrum of Schaaf-Yang syndrome: 18 new affected individuals from 14 families[J]. Genet Med, 2017,19(1):45-52. DOI: 10.1038/gim.2016.53. [18] Kleinendorst L, Pi Castán G, Caro-Llopis A, et al. The role of obesity in the fatal outcome of Schaaf-Yang syndrome: Early onset morbid obesity in a patient with a MAGEL2 mutation[J]. Am J Med Genet A, 2018,176(11):2456-2459. DOI: 10.1002/ajmg.a.40486. [19] Xiao B, Ji X, Wei W, et al. A recurrent variant in MAGEL2 in five siblings with severe respiratory disturbance after birth[J]. Mol Syndromol, 2020,10(5):286-290. DOI: 10.1159/000501376. [20] Schaaf CP, Marbach F. Schaaf-Yang Syndrome[EB/OL]. (2021-03-01) [2021-02-11]. https://www.ncbi.nlm.nih.gov/books/NBK567492/.
