中华医学会
地址: 中国北京东四西大街42号
邮编: 100710
人类婆罗双树样基因1新发变异致Townes-Brocks综合征1例并文献复习
摘要
目的 总结Townes-Brocks综合征(Townes-Brocks syndrome,TBS)患儿的临床特征及基因变异特点。
方法 回顾性分析2022年5月甘肃省妇幼保健院诊治的1例人类婆罗双树样基因1 (spalt-like transcription factor 1,SALL1)变异导致的TBS患儿的临床资料。并以“SALL1基因”“Townes-Brocks综合征”检索中国知网数据库、维普数据库、万方数据库及中华医学期刊网,以“SALL1 gene”“Townes-Brocks syndrome”检索PubMed数据库,检索时间为建库至2022年7月。选择SALL1基因变异所致TBS病例,并重点对SALL1基因移码变异所致TBS患者的临床表型-基因型进行分析总结。采用描述性统计分析。
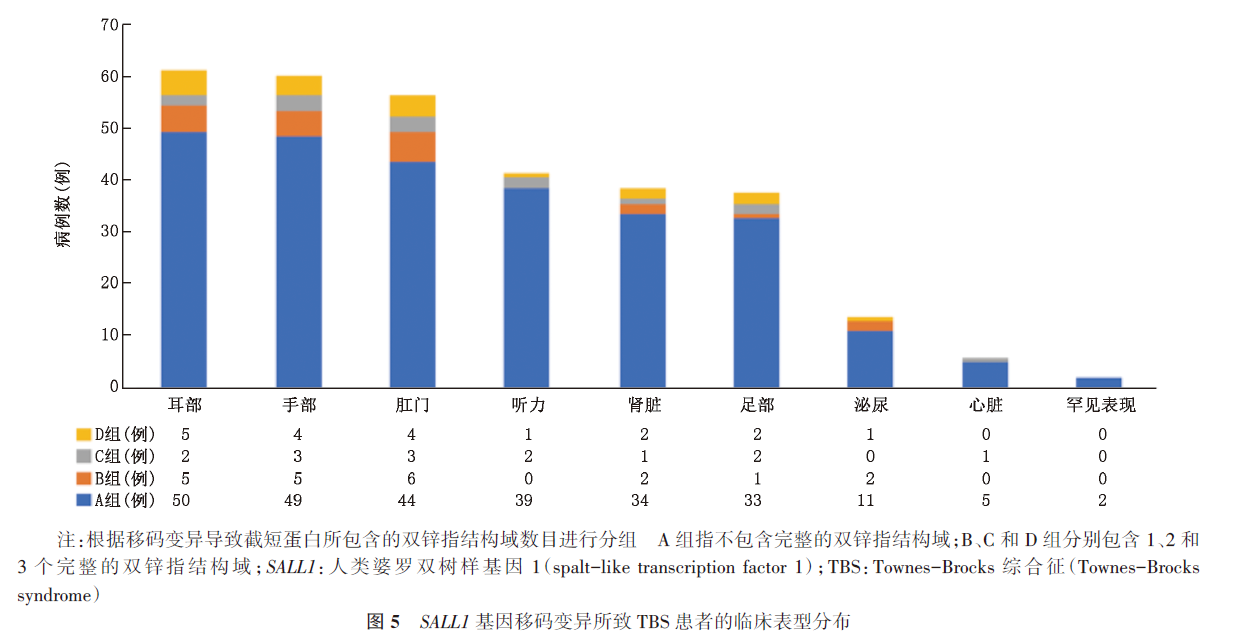
结果 (1)本院患儿女,40 d,以多囊性肾发育不良、先天性外耳畸形、轴前多指畸形及直肠会阴瘘为主要临床表现。全外显子组测序及Sanger测序验证显示患儿SALL1基因存在c.420delC(p.S141fs*42)杂合变异,该变异初步判定为致病:PVS1+PS2+PM2。父母及姐姐均为野生型。(2)文献复习:共检索到TBS病例161例,其中SALL1基因移码变异所致TBS病例71例,加之本例,共72例。TBS的典型临床表现主要是外耳畸形、手部畸形和肛门畸形,并伴有听力损失、肾发育异常和足部畸形等,少部分患儿伴有眼部异常、甲状腺功能减退及发育异常等罕见临床表型。目前人类基因变异数据库共收录SALL1基因变异110种,大部分变异位于2号外显子,包括移码变异、错义变异和无义变异等,其中移码变异(52%)最常见。
结论 当患儿出现耳部、手部及肛门畸形,并伴有肾功能异常、听力损失等表现时应考虑到TBS的可能,建议尽快完善基因检测。
【关键词】 畸形, 多发性;肛门闭锁;听力损失,感音神经性;拇指;转录因子
基金项目:国家自然科学基金(12005042);甘肃省科技计划(21JR7RA680、21JR1RA045、22YF7WA092);甘肃卫生行业科研计划(GSWSKY2021-021)
Townes-Brocks综合征(Townes-Brocks syndrome,TBS;在线人类孟德尔遗传数据库编号107480)是由Townes和Brocks于1972年首次描述的一种罕见的常染色体显性遗传病,发病率为1/250 000[1]。TBS的临床表型存在高度异质性,可累及多器官,典型临床三联征包括肛门畸形(肛门闭锁、肛门前置和肛门狭窄)、手部畸形(轴前多指、三指拇指及拇指发育不全等)和外耳畸形(小耳畸形、耳低位和耳螺旋折叠等)[2-3],次要临床表型包括感音神经性或传导性听力障碍、肾功能损害伴或不伴肾畸形、先天性心脏缺陷、足部畸形和泌尿生殖系统畸形等[4],罕见临床表型有先天性甲状腺功能减退和生长发育迟缓等[5]。人类婆罗双树样基因(spalt-like transcription factor,SALL)1(MIM:602218)是TBS的主要致病基因[6]。迄今为止,在TBS患者中检出的大部分SALL1基因致病性变异都为终止密码子提前出现,使SALL1蛋白翻译提前终止,这些蛋白质缺乏大多数锌指结构,只保留了N-末端结构域[7]。研究表明,SALL1基因的致病性变异可能源于该基因单倍体剂量不足或显性负效应[8-9]。本文报道1例SALL1基因杂合变异的TBS患儿,总结其临床表型及基因变异特征,并进行文献复习,旨在提高临床对TBS的认识。
一、资料与方法
1.病例资料:回顾性分析2022年5月甘肃省妇幼保健院诊治的1例TBS患儿的临床资料。本研究经甘肃省妇幼保健院伦理委员会批准(2021[65])。
2.文献复习:以“SALL1基因”“Townes-Brocks综合征”为关键词,检索中国知网数据库、维普数据库、万方数据库及中华医学期刊网,以“SALL1 gene”“Townes-Brocks syndrome”为关键词检索PubMed数据库,检索时间为建库至2022年7月。选择SALL1基因变异所致的TBS病例,并重点对SALL1基因移码变异所致TBS患者的临床表型-基因型进行分析总结。
3.统计学分析:采用描述性统计分析。
二、结果
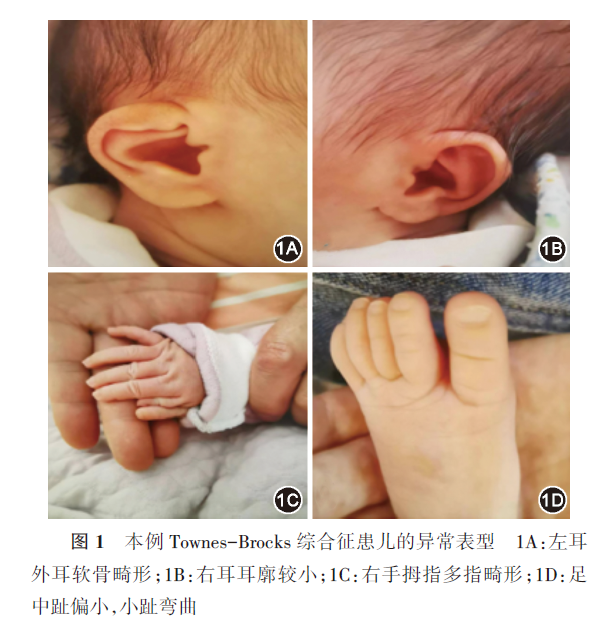
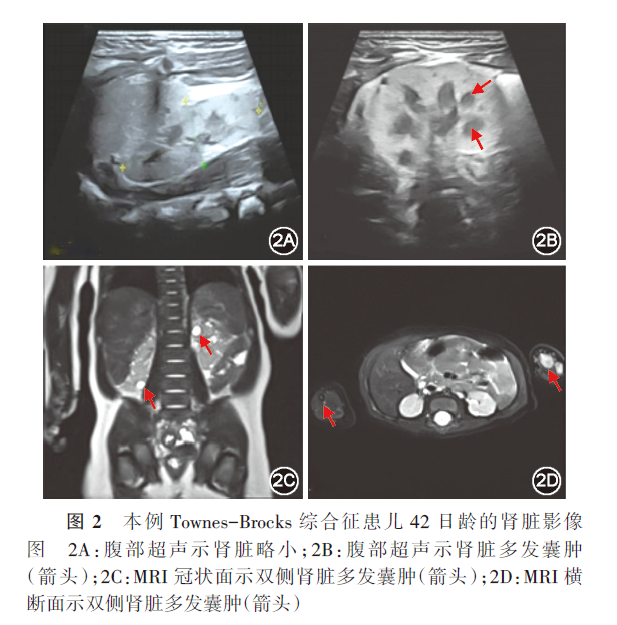
1.本例患儿临床资料:先证者女,40 d,第2胎第2产,足月阴道分娩出生,产前超声提示双肾偏小。有一姐姐,8岁,体健。父母非近亲结婚,体健。无家族史。患儿因1 d前外院超声提示多囊肾、外耳软骨缺损,于2022年5月25日就诊于本院。入院体格检查:精神反应可,喂养困难,Gesell婴幼儿发展量表显示发育迟缓。左耳外耳软骨畸形(上缘过度折叠)(图1A),右耳发育不良,耳廓较小(图1B)。肛周无脓肿及皮疹,肛门前移,直肠会阴瘘。手指多指畸形(图1C),足部畸形,中趾偏小,小趾弯曲(图1D)。四肢肌张力正常。实验室检查:血生化示间接胆红素15.6 μmol/L(参考值2~14 μmol/L),铜蓝蛋白0.13 g/L(参考值0.6~0.45 g/L),尿素氮5.7 mmol/L(参考值0.8~5.3 mmol/L),肌酐53 μmol/L(参考值13~33μmol/L),尿素/肌酐0.11(参考值0.15~0.24),胱抑素C 3.30 mg/L(参考值0.59~1.03 mg/L),提示患儿肾功能发育异常。尿常规示红细胞33个/μl(参考值0~9个/μl),异常红细胞19个/μl(参考值0~2个/μl),正常红细胞14个/μl(参考值0~2个/μl)。听力筛查未通过。腹部彩超提示患儿肾脏体积略小并多发囊肿(图2A和2B)。MRI示双肾体积略小并多发囊肿(图2C和2D)。头颅MRI未见异常。
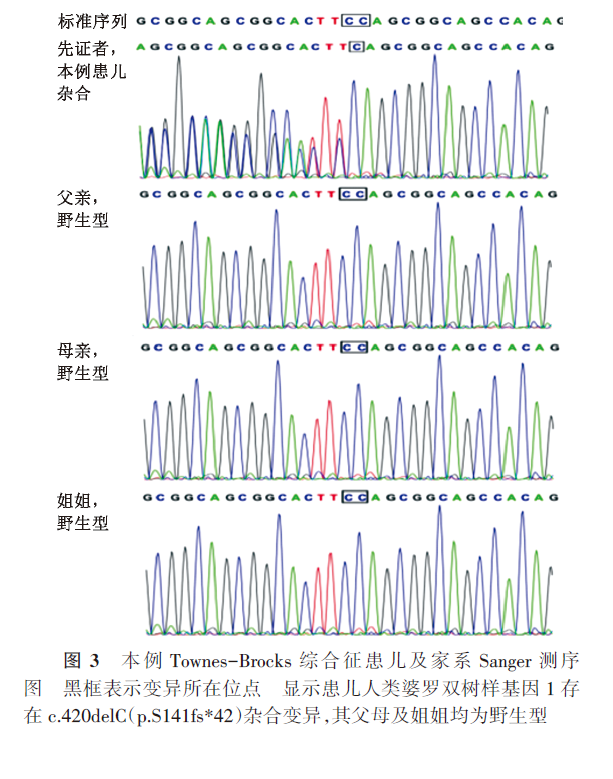
经本院伦理委员会批准并家长签署知情同意书后,进行家系全外显子组测序,并通过Sanger测序验证。结果显示患儿SALL1基因2号外显子存在c.420delC(p.S141fs*42)杂合变异,即SALL1基因第141位氨基酸发生移码变异,导致移码后的第42位提前引入终止密码子,从而使SALL1蛋白翻译提前终止。父母及姐姐均为野生型(图3)。经查询Clinvar数据库未见收录。根据美国医学遗传学与基因组学学会指南[10],该变异初步判定为致病:PVS1+PS2+PM2。证据如下:c.420delC使氨基酸发生移码变异p.S141fs*42,生成仅含有182个氨基酸的截短蛋白,为极强致病性证据;经家系验证分析,患儿父母该位点均无变异,该变异为新发变异(PS2);在千人基因组、人类外显子数据库、人类外显子东亚人数据库及基因组整合数据库中未收录(PM2)。该基因变异关联疾病为TBS。
三、讨论
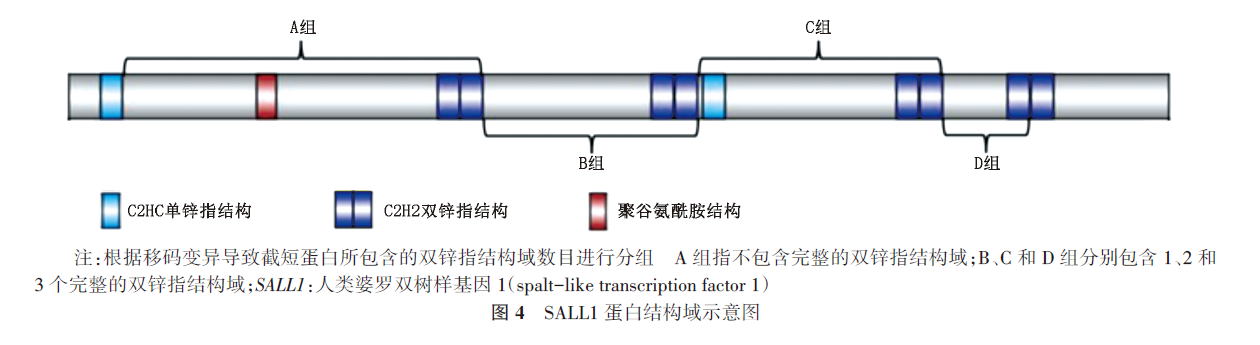
1.TBS的致病基因:SALL1基因变异是引起TBS的主要原因,其编码的SALL1蛋白是肾脏、耳、肢体、脑、肝脏及泌尿生殖系统/器官的重要发育调节因子[1, 11]。SALL1基因位于染色体16q12.1,其编码的锌指蛋白SALL1包含4个高度保守的C2H2结构域和2个单锌指C2HC结构域,其中第4个C2H2结构域对于SALL家族识别富含AT的序列以抑制多种基因的表达是必不可少的,该锌指簇可与富含保守的AT基序的不同双链DNA结合,调控不同的复合物以介导基因转录,从而在胚胎发育中发挥重要作用[2,12]。SALL1蛋白N-末端的前136个氨基酸基序可通过募集并结合核小体重塑脱乙酰化酶复合物[13],改变染色质组装过程中DNA区域的紧密程度,从而通过染色质重塑介导转录抑制,同时SALL1还包含一个参与自身或其他SALL家族成员二聚化的聚谷氨酰胺结构域,调节自身活性[2, 14]。当SALL1基因发生变异时将引起蛋白质空间结构的改变,使其调控的下游基因表达异常,引发TBS表型,即受累者出现肛门、外耳、四肢和泌尿生殖系统或器官的一系列先天性畸形[8]
2.TBS的基因型-表型:SALL1基因包含3个外显子和2个内含子,该基因变异大部分位于2号外显子[15-16],即变异热点区域。目前人类基因变异数据库共收录110个SALL1基因变异,大部分变异位于2号外显子,最常见的变异类型为移码变异(52%),其次为无义变异(22%)、错义变异(13%)、大片段的缺失/重复(11%)、整码变异(3%)及剪接变异(1%)。既往研究认为,SALL1基因的致病性变异源于其单倍体剂量不足[9],但在SALL1基因敲除小鼠模型中发现SALL1杂合子没有表型,在纯合子只表现为孤立性肾脏缺陷,没有表现出TBS样畸形[17]。这表明SALL1变异可能会产生截短蛋白,且大部分的截短蛋白只保留了N-端聚谷氨酰胺结构域,而缺乏与DNA相互作用的锌指结构域,变异的SALL1可与野生型SALL1蛋白或其他SALL蛋白异二聚化发挥显性负效应机制,引起下游基因异常表达,从而使受累者出现相关的临床表型。本研究经文献复习发现,已报道的2个SALL1基因变异(c.313delA 和 c.419delC)会导致缺少聚谷氨酰胺结构域的截短蛋白质产生,这些截短蛋白也能与其他SALL蛋白相互作用,但亲和力有所降低[18],从而破坏靶基因的调节作用。推测本例患儿(c.420delC)也可能因缺乏聚谷氨酰胺结构域而与其他SALL蛋白结合时亲和力降低,因此干扰了其他SALL蛋白的功能,引发患儿TBS相关临床表型。通过分析以上3例患儿(c.313delA、c.419delC和c.420delC变异病例)的临床特征,没有发现明显差异,均符合典型的TBS表型,这表明富含谷氨酰胺的结构域至少不是典型TBS所必需的。另外,本研究通过文献复习,发现随着保留的C2H2结构域的增加,受累者的临床表型相对轻微。国外研究也曾发现第2外显子中靠近5'端热点区域内的致病变异体比靠近3'端的致病变异体可导致更严重的TBS表型[18]。这可能与保留更多的锌指结构后,SALL1蛋白功能也更大程度地保留相关。然而,SALL1蛋白结构中包含4个C2H2结构域的突变体,锌指结构的缺失程度不是影响其蛋白功能的唯一因素,其蛋白功能也有所差异。由于SALL1基因在外周血中几乎不表达,患儿家属拒绝采集样本进行进一步的检测,因此未能进行SALL1蛋白的功能验证。因此,不同位点的SALL1基因变异与所致TBS表型异质性的相关性需要进一步研究。
3.TBS的临床特征及鉴别诊断:本例患儿主要临床表型为外耳畸形、轴前多指畸形和直肠会阴瘘,符合TBS的典型三联征。临床诊断中该病应与VACTERAL综合征进行鉴别,当患者存在椎骨畸形、肛门闭锁、心脏畸形、气管食管瘘/食管闭锁、肾畸形及肢体畸形中3个或3个以上系统的器官受累时,即可诊断为VACTERAL综合征[19]。VACTERAL综合征是一种涉及多器官的先天性畸形,目前尚未检索到相关的致病基因报道[20];而TBS主要由SALL1基因变异导致。
除以上临床表型外,本例患儿腹部超声和MRI均提示双肾体积略小并多发囊肿,且实验室检查提示肾功能异常。SALL1蛋白在胚胎肾脏中大量表达,可调控肾脏发育相关基因的表达,在哺乳动物肾脏发育中起关键作用[21]。有研究发现TBS患者肾脏异常的发生率为20%~62.5%,且具有异质性,包括肾发育不全、多囊肾、膀胱输尿管反流或尿道狭窄等[11]。本例患儿表现符合TBS肾脏异常表型。当TBS患者存在多囊性肾发育不良时,需与常染色体隐性遗传性多囊肾病(autosomal recessive polycystic kidney disease,ARPKD)相鉴别,ARPKD主要病因为6号染色体上的纤囊蛋白基因发生变异,导致纤囊素缺失,从而呈现出肾脏海绵样肿大以及胆管的功能异常,且同时伴有肝纤维化和先天性肝内胆管发育不良[22]。而本例患儿虽表现为多囊性肾脏改变,但其双肾体积减小,且肝胆大小、形态及发育未见明显异常,因此可排除ARPKD。肾发育不良曾被认为是孤立性TBS的表型[23],因此无论TBS患者是否出现肾脏异常,都建议及早进行肾功能检测及肾脏影像学检查。另外,本例患儿胆红素升高以间接胆红素升高为主,结合尿常规中红细胞增加,考虑患儿存在溶血性黄疸,出现该表型的原因可能是新生儿红细胞数量多、寿命短、破坏增加,导致胆红素生成过多,同时患儿肾功能不全存在排泄障碍,从而出现黄疸。
4.TBS的治疗与随访:TBS尚无特异的治疗方案,目前以对症治疗为主。对于存在肛门畸形、肢体畸形及合并先天性心脏病的患者需进行外科手术治疗或药物治疗,若合并肾功能发育异常需密切监测肾功能指标,并及时调整治疗方案。因TBS患者存在耳发育异常,伴或不伴肾发育不良,治疗过程中还应避免使用耳毒性和肾毒性药物,以防加重病情。电话随访本例患儿,目前1岁,家属称在外院进行了手指畸形矫正手术,听力复筛一次未通过,家属自述患儿对声音可作出反应,但未行内耳相关检查。
5.总结:本研究报道了1例TBS患儿,病因是SALL1基因c.420delC(p.S141fs*42)变异,经数据库查询该变异未见报道,扩展了SALL1基因变异谱。同时进行了文献分析,总结了TBS患儿的临床特点及基因变异特点,希望有助于TBS的诊断及遗传咨询。
利益冲突 所有作者声明无利益冲突
参考文献
[1] Liberalesso P, Cordeiro ML, Karuta S, et al. Phenotypic and genotypic aspects of Townes-Brock syndrome: case report of patient in southern Brazil with a newSALL1 hotspot region nonsense mutation[J]. BMC Med Genet, 2017,18(1):125. DOI: 10.1186/s12881-017-0483-7.
[2] Bozal-Basterra L, Martín-Ruíz I, Pirone L, et al. Truncated SALL1 impedes primary cilia function in Townes-Brocks syndrome[J]. Am J Hum Genet, 2018,102(2):249-265. DOI: 10. 1016/j.ajhg.2017.12.017.
[3] Yang G, Yin Y, Tan Z, et al. Whole-exome sequencing identified a novel heterozygous mutation of SALL1 and a new homozygous mutation of PTPRQ in a Chinese family with Townes-Brocks syndrome and hearing loss[J]. BMC Med Genomics, 2021,14(1):24. DOI: 10.1186/s12920-021-00871-9.
[4] Elkaiali L, Ratliff K, Oueis H. Dental treatment considerations for children with complex medical histories: A case of Townes-Brock syndrome[J]. J Mich Dent Assoc, 2016,98(1):32-34.
[5] Valikodath NG, Jain S, Miller M, et al. Ocular features of Townes-Brocks syndrome[J]. J AAPOS, 2020,24(2):115-118. DOI: 10.1016/j.jaapos.2019.12.004.
[6] Kohlhase J, Wischermann A, Reichenbach H, et al. Mutations in the SALL1putative transcription factor gene cause Townes-Brocks syndrome[J]. Nat Genet, 1998,18(1):81-83. DOI: 10.1038/ng0198-81.
[7] 魏海霞, 孙良忠, 李敏, 等. 一例无肛门闭锁的Townes-Brocks综合征患儿的SALL1基因变异分析[J].中华医学遗传学杂志,2022,39(4):401-404. DOI: 10.3760/cma.j.cn511374-20200831- 00637.
Wei HX, Sun LZ, Li M, et al. Analysis of SALL1gene variant in a boy with Townes-Brocks syndrome without anal atresia[J].Chin J Med Genet,2022,39(4):401-404. DOI: 10.3760/cma.j.cn511374-20200831-00637.
[8] Kiefer SM, Robbins L, Barina A, et al. SALL1 truncated protein expression in Townes-Brocks syndrome leads to ectopic expression of downstream genes [J]. Hum Mutat, 2008, 29(9): 1133-1140.
[9] Miller EM, Hopkin R, BAO L, et al. Implications for genotype-phenotype predictions in Townes-Brocks syndrome: case report of a novel SALL1 deletion and review of the literature [J]. Am J Med Genet A, 2012, 158a(3): 533-540.
[10] Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015,17(5):405-424. DOI: 10.1038/gim.2015.30.
[11] Lin FJ, Lu W, Gale D, et al. Delayed diagnosis of Townes-Brocks syndrome with multicystic kidneys and renal failure caused by a novel SALL1 nonsense mutation: A case report[J]. Exp Ther Med, 2016,11(4):1249-1252. DOI: 10.3892/etm.2016.3035.
[12] Ru W, Koga T, Wang X, et al. Structural studies of SALL family protein zinc finger cluster domains in complex with DNA reveal preferential binding to an AATA tetranucleotide motif [J]. J Biol Chem, 2022, 298(12): 102607.
[13] Ma C, Wang F, Han B, et al. SALL1 functions as a tumor suppressor in breast cancer by regulating cancer cell senescence and metastasis through the NuRD complex [J]. Mol Cancer, 2018, 17(1): 78. DOI: 10.1186/s12943-018-0824-y.
[14] Sweetman D, Smith T, Farrell ER, et al. The conserved glutamine-rich region of chick csal1 and csal3 mediates protein interactions with other spalt family members. Implications for Townes-Brocks syndrome[J]. J Biol Chem, 2003,278(8):6560-6566. DOI: 10.1074/jbc.M209066200.
[15] Botzenhart EM, Green A, Ilyina H, et al. SALL1 mutation analysis in Townes-Brocks syndrome: twelve novel mutations and expansion of the phenotype[J]. Hum Mutat, 2005,26(3):282. DOI: 10.1002/humu.9362.
[16] Sato A, Kishida S, Tanaka T, et al. Sall1, a causative gene for Townes-Brocks syndrome, enhances the canonical Wnt signaling by localizing to heterochromatin[J]. Biochem Biophys Res Commun, 2004,319(1):103-113. DOI: 10.1016/j.bbrc.2004. 04.156.
[17] Nishinakamura R, Matsumoto Y, Nakao K, et al. Murine homolog of SALL1 is essential for ureteric bud invasion in kidney development [J]. Development, 2001, 128(16): 3105- 3115.
[18] Botzenhart EM, Bartalini G, Blair E, et al. Townes-Brocks syndrome: twenty novel SALL1mutations in sporadic and familial cases and refinement of the SALL1 hot spot region[J]. Hum Mutat, 2007,28(2):204-205. DOI: 10.1002/humu.9476.
[19] Solomon BD. VACTERL/VATER association[J]. Orphanet J Rare Dis, 2011,6:56. DOI: 10.1186/1750-1172-6-56.
[20] Solomon BD. The etiology of VACTERL association: Current knowledge and hypotheses[J]. Am J Med Genet C Semin Med Genet, 2018,178(4):440-446. DOI: 10.1002/ajmg.c.31664.
[21] Nishinakamura R, Takasato M. Essential roles of Sall1 in kidney development[J]. Kidney Int, 2005,68(5):1948-1950. DOI: 10. 1111/j.1523-1755.2005.00626.x.
[22] Goggolidou P, Richards T. The genetics of autosomal recessive polycystic kidney disease (ARPKD)[J]. Biochim Biophys Acta Mol Basis Dis, 2022,1868(4):166348. DOI: 10.1016/j.bbadis. 2022.166348.
[23] Weber S, Moriniere V, Knüppel T, et al. Prevalence of mutations in renal developmental genes in children with renal hypodysplasia: results of the ESCAPE study[J]. J Am Soc Nephrol, 2006,17(10):2864-2870. DOI: 10.1681/ASN. 2006030277.
本文引用格式:令军鹤, 王玉佩, 唐娇, 等. 人类婆罗双树样基因1新发变异致Townes-Brocks综合征1例并文献复习[J]. 中华围产医学杂志, 2023, 26(7): 591-596. DOI: 10.3760/cma.j.cn113903-20221119-00972.
来源:中华围产医学杂志
作者:令军鹤1,2 王玉佩1,3 唐娇1,2 田芯瑗1,2 徐度玲4 郝胜菊1,3 惠玲1,3
单位:1甘肃省妇幼保健院(甘肃省中心医院)医学遗传中心;2甘肃中医药大学公共卫生学院;3甘肃省出生缺陷与罕见病临床医学研究中心;4中国科学院近代物理研究所医学物理系
