中华医学会
地址: 中国北京东四西大街42号
邮编: 100710
不同剂量维生素D对极低出生体重儿血清钙、磷、碱性磷酸酶和25-羟维生素D 水平的影响
本文引用格式: 邓庆先,林梅芳,袁新华,等.不同剂量维生素D对极低出生体重儿血清钙、磷、碱性磷酸酶和25-羟维生素D水平的影响[J]. 中华围产医学杂志, 2017,20(3):223-227. DOI:10.3760/cma.j.issn.1007-9408.2017.03.015
【摘 要】 目的 了解补充不同剂量维生素D对极低出生体重儿血清钙、磷、碱性磷酸酶及25-羟维生素D水平的影响,为极低出生体重儿代谢性骨病的早期预防提供指导。 方法 选择2014年1月至2016年1月入住浙江省湖州市妇幼保健院新生儿科的90例极低出生体重儿为研究对象,随机分为高剂量组和低剂量组,于8日龄开始高剂量组予维生素D 900 U/d口服,低剂量组予400 U/d口服。分别于1、7、21、42日龄检测血清钙、磷、碱性磷酸酶水平,7、21、42日龄检测血清25-羟维生素D水平。采用两独立样本t检验、χ2检验、单因素方差分析及LSD或Dunnett's T3检验进行统计学分析。 结果 高剂量组和低剂量组1、7日龄的血清钙、磷和碱性磷酸酶,以及7日龄时的25-羟维生素D水平差异无统计学意义(P值均>0.05)。21日龄时,高剂量组血清钙、磷和25-羟维生素D水平均较低剂量组高[分别为(2.38±0.09)与(2.04±0.15) mmol/L,t=2.421;(1.80±0.50)与(1.71±0.60)mmol/L,t=0.637;(45.58±18.43)与(42.53±16.33)nmol/L,t=0.421],碱性磷酸酶较低剂量组低[(505.12±185.61)与(588.32±168.72)U/L,t=5.314];差异均有统计学意义(P值均<0.05)。42日龄时结果与21日龄时一致。高剂量组7、21和42日龄血清钙水平高于1日龄[分别为(2.43±0.13)、(2.38±0.09)、(2.39±0.08)与(2.06±0.57)mmol/L];血清磷水平在7日龄时低于1、21和42日龄[分别为(1.31±0.26)与(1.89±0.39)、(1.80±0.50)、(1.98±0.30)mmol/L];血清碱性磷酸酶在7、21和42日龄高于1日龄[分别为(475.18±133.73)、(505.12±185.61)、(538.43±168.16)与(296.15±99.41)U/L],42日龄高于7日龄;血清25-羟维生素D水平在21日龄明显高于7日龄,42日龄明显高于7和21日龄[分别为(73.55±23.65)与(30.63±12.66)和(45.58±18.43)nmol/L];差异均有统计学意义(LSD或Dunnett's T3检验,P值均<0.05)。 结论 极低出生体重儿8日龄开始补充维生素D能改善钙磷代谢状态,900 U/d效果好于400 U/d。 【关键词】 婴儿,极低出生体重;维生素D;钙;磷;碱性磷酸酶;生物学标记
世界卫生组织将极低出生体重儿(very low birth weight infant,VLBWI)定义为出生体重1 000~1 500 g的早产儿。近年来随着围产医学和新生儿救治与监护技术的快速发展,VLBWI的存活率得到极大提高,但由于其先天钙磷储备不足以及生后多种不利因素的影响,发生代谢性骨病的风险仍较高。血清磷和碱性磷酸酶是骨代谢的生化标记物[1-2],25-羟维生素D因在人体中稳定且浓度较高,常作为衡量维生素D营养状况的良好指标[3],血清钙、磷、碱性磷酸酶水平的测定在代谢性骨病的早期诊断、预防和治疗中具有重要意义。早产儿是维生素D缺乏的高危人群,尤其是VLBWI,了解其生后早期维生素D的营养状况并及时适量补充,对改善其体质有重要意义。本研究以VLBWI为研究对象,测定补充不同剂量维生素D对其血清钙、磷、碱性磷酸酶和25-羟维生素D水平的影响,为维生素D的补充提供临床指导。
资料与方法
一、研究对象
从2014年1月至2016年1月在浙江省湖州市妇幼保健院新生儿科住院患儿中选择。入选标准:(1)无严重畸形;(2)生后2 h内入住新生儿科;(3)住院时间>42 d;(4)胎龄<37周且出生体重<1 500 g;(5)母亲无代谢性骨病。排除标准:超低出生体重儿、新生儿窒息、围产期感染、遗传代谢病。符合标准者90例纳入研究。
二、研究方法
1.分组:90例患儿随机分为高剂量组(补充维生素D 900 U/d)和低剂量组(补充维生素D400 U/d),每组45例。所有患儿均于8日龄开始口服维生素D,高剂量组每日予维生素AD滴剂(胶囊型,含维生素A 1 500 U;维生素D 500 U)与维生素D滴剂(胶囊型,含维生素D 400 U)各1粒;低剂量组每日予维生素D滴剂(胶囊型,含维生素D 400 U)1粒。所有患儿均予同种早产儿配方奶喂养,直至全奶量达160 ml/kg,不足部分予胃肠外营养支持。本研究经医院伦理委员会批准,征得患儿家属知情同意并签署知情同意书。
2.血清钙、磷、碱性磷酸酶和25-羟维生素D水平检测:1日龄采血时间为入院2 h内,7、21和42日龄采血时间为清晨喂奶前,抽取患儿静脉血2 ml,所采取标本均于当天检测。采用全自动生化分析仪测定血清钙、磷、碱性磷酸酶水平(试剂盒均为北京利德曼生物股份有限公司提供,仪器为日本日立牌7600型生化分析仪)。血清25-羟维生素D水平采用电化学发光法测定[罗氏诊断产品(上海)有限公司试剂盒]。
三、统计学分析
采用SPSS 18.0统计软件包。符合正态分布的计量资料用x±s表示,2组间比较采用两独立样本t检验,多组样本均数比较采用单因素方差分析,两两比较时方差齐则采用LSD检验,方差不齐则采用Dunnett's T3检验;计数资料采用频数及率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一、一般资料
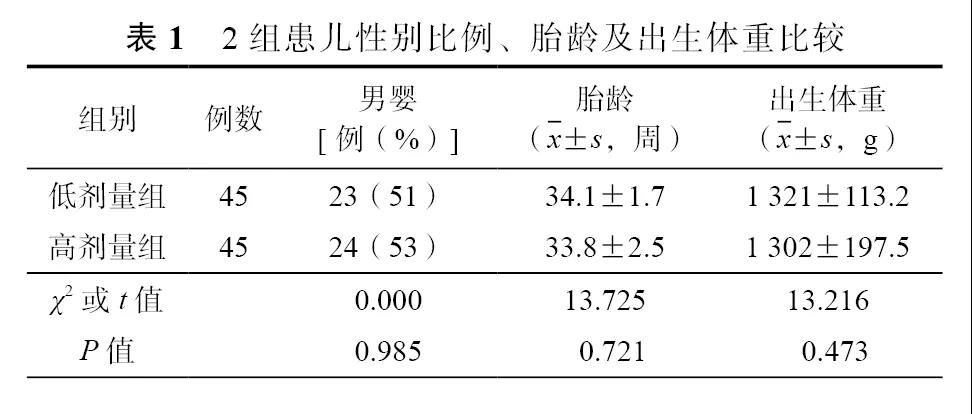
2组患儿的性别比例、胎龄和出生体重差异无统计学意义(P值均>0.05)。见表1。
二、2组血清钙、磷、碱性磷酸酶和25-羟维生素D水平比较
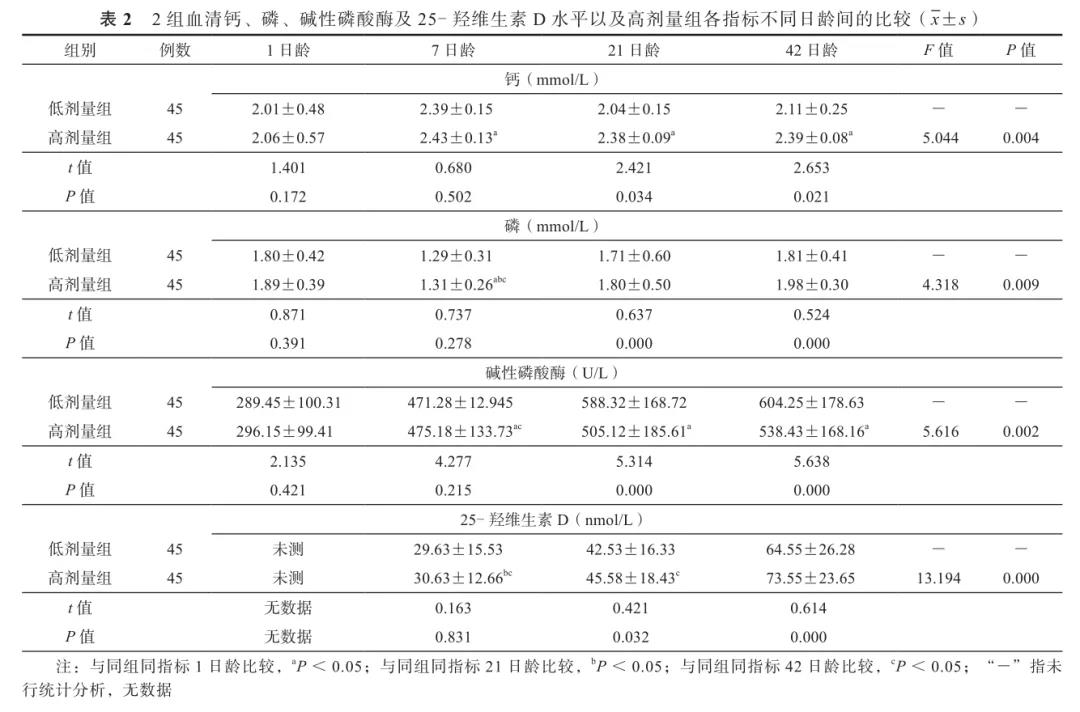
2组1、7日龄的血清钙、磷和碱性磷酸酶,以及7日龄时的25-羟维生素D水平差异无统计学意义(P值均>0.05);21和42日龄时,高剂量组血清钙、磷和25-羟维生素D水平较低剂量组高,碱性磷酸酶水平较低剂量组低,差异有统计学意义(P值均<0.05)。见表2。
三、高剂量组不同日龄血清钙、磷、碱性磷酸酶及25-羟维生素D水平变化
高剂量组7、21和42日龄血清钙水平高于1日龄,差异有统计学意义(LSD检验,P值分别为0.001、0.003和0.004)。血清磷水平在7日龄时低于1、21和42日龄(LSD或Dunnett's T3检验,P值分别为0.000、0.001和0.000)。血清碱性磷酸酶水平呈逐渐上升趋势,7、21和42日龄高于1日龄(LSD或Dunnett's T3检验,P值分别为0.001、0.000和0.000),42日龄高于7日龄(Dunnett's T3检验,P=0.000)。血清25-羟维生素D水平在21日龄明显高于7日龄(LSD检验,P=0.035),42日龄明显高于7和21日龄(LSD检验,P值均为0.000)。见表2。
讨 论
维生素D是一组具有生物活性的脂溶性类固醇衍生物,是维持人体内钙稳态的重要生物调节因子,也是人类生长发育不可缺少的维生素之一。其最主要的功能是调节体内钙磷代谢,维持血清钙、磷水平,促进骨矿化。早产儿维生素D缺乏、骨代谢异常严重影响其生长发育,是新生儿临床关注的重点[4-6]。目前相关研究多集中于儿童、成年人体内维生素D水平,关于VLBWI的研究较少。国内研究动态监测1、14和30日龄新生儿血清25-羟维生素D水平,结果发现分别有76.8%(73/95)、53.7%(51/95)和75.8%(72/95)的新生儿存在维生素D缺乏[7]。且早产儿血清25-羟维生素D水平低于足月儿[8]。国外一项研究纳入34例早产儿,平均胎龄为31.4周,出生体重平均为1 677 g,脐带血25-羟维生素D水平平均为14.5 nmol/L,其中15例(44%)有严重的维生素D缺乏[9]。不仅如此,早产儿容易出现代谢性骨病,出生体重越低代谢性骨病的发生率越高,程度越严重[10]。大部分骨矿化及钙磷沉积发生于妊娠最后3个月,早产儿在这一时期之前出生可因维生素D及钙磷摄入不足造成钙磷缺失,导致矿物质储存不足,且长期胃肠外营养、喂养不耐受以及应用影响骨代谢的药物(如咖啡因等)可加重骨矿化不全,因此维生素D制剂的补充对早产儿尤其是VLBWI尤为重要。
一、血清钙水平及其意义
新生儿正常血清总钙为2.25~2.75 mmol/L,当血清总钙<1.8 mmol/L或血清离子钙<0.9 mmol/L称为低钙血症[11]。本研究结果提示,VLBWI出生时存在血清钙不足,随着出生日龄的增加,血清钙呈上升趋势,7日龄时表达量较高,以后上升不明显,与国内其他研究[12]一致。这可能与早产儿发生骨代谢异常时会牺牲一定的骨钙保持正常的血清钙有关,因为当患儿骨钙的释放达到一定程度时,自身保护机制会停止骨钙释放,所以即使补充维生素D,但在没有口服或静脉补充钙剂时,血清钙上升不明显。
二、血清磷水平及其意义
VLBWI在生后早期血清磷水平降低,血清磷水平可作为早期诊断代谢性骨病的重要指标。早产儿血清磷<2 mmol/L可能表明矿物质摄入不足,血清磷<1.8 mmol/L时常存在明显佝偻病影像学改变[13]。血清碱性磷酸酶>900 U/L、结合磷<1.8 mmol/L诊断代谢性骨病的敏感性可达100%,特异性达70%[14]。本研究提示,VLBWI在生后早期有血清磷水平的降低,7日龄血清磷处于最低水平,低于1、21和42日龄,可能与早产儿甲状旁腺功能低下、肾和骨等靶器官对甲状旁腺激素的反应低下有关[15]。血清磷随着日龄、奶量的增加及维生素D的补充之后呈上升趋势,高剂量组至21日龄时基本恢复至出生时水平,虽然高剂量组42日龄时较21日龄时升高,但差异无统计学意义(P=0.201),这可能是由于VLBWI本身骨骼发育落后,钙磷沉积含量少,早产儿配方奶中钙磷含量也不能满足其生长所需,且VLBWI生活能力差,吸吮力弱,这些都局限了磷的摄入。同时本研究提示,高剂量组和低剂量组VLBWI 42日龄时血清磷水平分别为(1.98±0.30)和(1.81±0.41) mmol/L(P=0.000),均处于低水平状态。所以,必要时需对VLBWI口服或静脉补磷。
三、血清碱性磷酸酶水平及其意义
碱性磷酸酶是一组有酶活性的膜蛋白,由成骨细胞合成,是成骨细胞活性标志之一。早产儿维生素D与钙供给不足可进一步导致骨矿化异常,以致血清碱性磷酸酶水平不断升高。目前对于早产儿血清碱性磷酸酶没有公认的参考值,但其出生时血清碱性磷酸酶均高于足月儿,VLBWI尤为明显[16]。本研究发现VLBWI生后血清碱性磷酸酶呈上升趋势,42日龄时高剂量组和低剂量组血清碱性磷酸酶分别为(538.43±168.16)和(604.25±178.63) U/L(P=0.000),而导致VLBWI血清碱性磷酸酶水平升高的原因主要是VLBWI体内25-羟维生素D水平低,骨钙化不足,成骨细胞活跃。这与其他文献报道[14,16]一致。由此可见,血清碱性磷酸酶可作为早产儿代谢性骨病风险评估的常用指标。
四、血清25-羟维生素D水平及其意义
25-羟维生素D是维生素D代谢的中间产物,又是合成活性1,25-二羟维生素D3的前体,在血液中水平最高,最稳定,半衰期最长,是反映体内维生素D营养状况的最佳指标,是佝偻病早期可靠的诊断指标。维生素D缺乏是指血清25-羟维生素D<50 nmol/L,<12.5 nmol/L为严重缺乏,>250 nmol/L 为维生素D过量,>375 nmol/L为中毒[17-18]。也有研究表明,血清25-羟维生素D最佳水平应≥75 nmol/L[19]。有研究对早产儿从出生时即补充维生素D 1 000 U/d,在3个月时25-羟维生素D水平达到了与足月儿相同的水平[20]。78%的早产儿血清25-羟维生素D水平低于50 nmol/L,当早产儿能耐受喂养后,血清25-羟维生素D水平低于50 nmol/L者补充维生素D 400 U/d,6周后87%的早产儿血清25-羟维生素D水平≥50 nmol/L,8%的早产儿>125 nmol/L[21]。52例胎龄<32周的早产儿生后第1天开始补充维生素D 400 U/d,7 d后血清25-羟维生素D从42.5 nmol/L提高到57.75 nmol/L[22]。本研究发现,VLBWI在7日龄时血清25-羟维生素D在高剂量组和低剂量组分别为(30.63±12.66)和(29.63±15.53)nmol/L,均处于低水平状态,与何必子等[23]的研究一致;随着日龄的增加及维生素D的补充,高剂量组与低剂量组血清25-羟维生素D水平均有增加,高剂量组和低剂量组在42日龄时血清25-羟维生素D水平分别为(73.55±23.65)和(64.55±26.28)nmol/L(P=0.000),且2组均未出现维生素D过量情况,说明补充维生素D 900 U/d对VLBWI来说是安全的,至于补充至何时改为常规剂量(400 U/d)[24]仍需进一步研究。
综上所述,VLBWI极易处于维生素D缺乏状态,需外源性补充。本研究对VLBWI进行不同剂量维生素D补充,至42日龄时高剂量组血清磷仍处于低水平状态,血清碱性磷酸酶仍高水平,血清25-羟维生素D水平未出现过量情况,说明补充维生素D 900 U/d对VLBWI来说是安全的和必要的,但是,关于900 U/d的剂量是否仍不足、常规剂量调整时间的把握以及是否将维生素D的补充提前至出生时仍有待研究。
参考文献 [1]董慧敏, 周文营, 罗敏琪. 血清钙、磷、锌元素及骨碱性磷酸酶在佝偻病患儿中的水平分析[J].中国儿童保健杂志, 2012, 20(5):469-471. [2]吴巧灵, 孙正芸, 林霞. 早产儿血清碱性磷酸酶、钙、磷的代谢特点[J].山东大学学报(医学版),2010,48(2):113-116,120. [3]田越, 吴海霞. 极低出生体重早产儿血清磷、骨碱性磷酸酶、25-羟基维生素D水平动态变化分析[J].中华流行病学杂志, 2015,36(11):1288-1290. DOI: 10.3760/cma.j.issn.0254-6450. 2015.11.021. [4]李敏, 于慧会, 时景璞. 25羟维生素D水平与心血管疾病关系的Meta分析[J].中华疾病控制杂志,2011,15(11):939-942. [5]杨苏, 杨潇, 李敏, 等. 儿童斑秃血清25-羟维生素D水平检测[J].中华全科医学,2014,12(3):380-381. [6]郭桂梅,王娟,夏敏,等.过敏性紫癜患儿血浆1,25(OH)2D3、维生素D受体和24-羟化酶表达的意义[J].中华实用儿科临床杂志,2013,28(21):1640-1642.DOI:10.3760/cma.j.issn.2095-428X.2013.21.013. [7]李军军, 丁晓春. 新生儿血清25羟维生素D3水平的动态变化及意义[J].中国儿童保健杂志,2012,20(2):130-131,148. [8]章晓英, 李宇宁, 安彩霞, 等. 新生儿维生素D营养状况调查[J].中国新生儿科杂志,2013,28(6):384-387. DOI: 10.3969/j.issn.1673-6710.2013.06.006. [9]Dawodu A, Nath R. High prevalence of moderately severe vitamin D deficiency in preterm infants[J]. Pediatr Int, 2011, 53(2):207-210. DOI: 10.1111/j.1442-200X.2010.03209.x. [10]Backström MC, Kuusela AL, Mäki R. Metabolic bone disease of prematurity[J]. Ann Med, 1996,28(4):275-282. [11]邵肖梅,叶鸿瑁,邱小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:764-765. [12]刘颖, 翟岩, 郭金和, 等. 早产儿维生素D补充效果及骨代谢指标的随访研究[J].中国全科医学,2016,19(7):790-793. DOI: 10.3969/j.issn.1007-9572.2016.07.011. [13]Backström MC, Kouri T, Kuusela AL, et al. Bone isoenzyme of serum alkaline phosphatase and serum inorganic phosphate in metabolic bone disease of prematurity[J]. Acta Paediatr, 2000, 89(7):867-873. [14]Trotter A, Pohlandt F. Calcium and phosphorus retention in extremely preterm infants supplemented individually[J]. Acta Paediatr, 2002,91(6):680-683. [15]黄烈平, 贝国平, 庄满利, 等. 早产儿早期钙、磷水平变化及其临床意义[J].中华围产医学杂志,2009,12(3):223-224. DOI: 10.3760/cma.j.issn.1007-9408.2009.03.020. [16]张乐嘉,丁国芳.早产儿代谢性骨病[J].中国实用儿科杂志, 2015,30(2):100-104. DOI:10.7504/ek2015020606. [17]Wagner CL, Greer FR. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents[J]. Pediatrics, 2008,122(5):1142-1152. DOI: 10.1542/peds.2008-1862. [18]邵洁. 儿童维生素D、钙营养与营养性维生素D缺乏性佝偻病判定与评价现状[J].中国实用儿科杂志, 2012,27(3):161-165. [19]Misra M, Pacaud D, Petryk A, et al. Vitamin D deficiency in children and its management: review of current knowledge and recommendations[J]. Pediatrics, 2008,122(2):398-417. DOI: 10.1542/peds.2007-1894. [20]Delvin EE, Salle BL, Claris O, et al. Oral vitamin A, E and D supplementation of pre-term newborns either breast-fed or formula-fed: a 3-month longitudinal study[J]. J Pediatr Gastroenterol Nutr, 2005,40(1):43-47. [21]McCarthy RA, McKenna MJ, Oyefeso O, et al. Vitamin D nutritional status in preterm infants and response to supplementation[J]. Br J Nutr, 2013,110(1):156-163. DOI: 10. 1017/S0007114512004722. [22]Hanson C, Armas L, Lyden E, et al. Vitamin D status and associations in newborn formula-fed infants during initial hospitalization[J]. J Am Diet Assoc, 2011,111(12):1836-1843. DOI: 10.1016/j.jada.2011.09.010. [23]何必子, 刘登礼, 郭少青, 等. 不同胎龄、不同出生体重新生儿出生时血清钙、磷、碱性磷酸酶和25-羟维生素D水平[J].中华围产医学杂志,2016,19(2):132-134. DOI: 10.3760/cma.j. issn.1007-9408.2016.02.011. [24]《中华儿科杂志》编辑委员会,中华医学会儿科学分会儿童保健学组,全国佝偻病防治科研协作组.维生素D缺乏性佝偻病防治建议[J].中华儿科杂志,2008,46(3):190-191.
