中华医学会
地址: 中国北京东四西大街42号
邮编: 100710
人类免疫缺陷病毒感染孕妇妊娠晚期快速母婴阻断抗病毒治疗
【摘要】人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染孕妇应尽早使用联合抗病毒治疗阻断HIV母婴传播,抗病毒治疗时间越早、越长,阻断效果越明显。但在临床上常见部分HIV感染孕妇直到妊娠晚期或临产前才来就诊,对这部分患者在保证安全的前提下,如何进行抗病毒治疗快速阻断HIV母婴传播,在选择药物时,除了考虑快速强效抑制病毒,还要注意药物对胎儿的安全性、脐带血药物浓度及新生儿药物洗脱等问题。本文就国内外孕妇感染HIV的现状、HIV母婴阻断用药现状及妊娠晚期HIV母婴阻断常用ARV药物等问题进行讨论。
【关键词】 HIV感染; 妊娠晚期; 治疗,抗病毒; 传染性疾病传播,垂直
获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS),即艾滋病,是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染引起的一类慢性传染性疾病,目前尚无法治愈[1]。
AIDS的流行已成为威胁人类健康的重大公共卫生问题,母婴传播是儿童感染HIV的主要方式,通过母婴传播预防策略和应用母婴传播阻断药物等措施的干预,可有效降低AIDS的传播率[2]。
抗病毒治疗时间越早,应用抗病毒药物时间越长,阻断效果越明显,但临床上仍不乏HIV感染孕妇直到妊娠晚期或临产前才来就诊的现象。
研究显示,妊娠晚期开始使用抗反转录病毒(antiretrovirals,ARV)药物治疗的患者,较妊娠早期或中期使用抗反转录病毒治疗(antiretroviral therapy, ART)的患者母婴传播风险增加7.78倍,婴儿死亡率翻倍,此类患者需高度关注[3]。
本文就国内外孕妇感染HIV的现状、HIV母婴阻断用药现状及妊娠晚期HIV母婴阻断的常用ARV药物等问题进行讨论。
一、国内外孕产妇感染HIV现状
近30年来,全球HIV感染人数逐步增加,已由1990年的874万升至2017年的3680万[4]。
在预防母婴传播措施的干预下,感染HIV的儿童数量已大幅减少,但2017年仍有超过13万1岁以下儿童新发感染,15岁以下儿童因HIV感染死亡超过12万[4]。
联合国艾滋病规划署(The Joint United Nations Programme on HIV and AIDS,UNAIDS)的统计数据显示,2018年全球有82%的孕妇接受ARV药物预防AIDS母婴传播,然而这一比例在亚太地区仅为56%[5]。
我国在应对AIDS流行方面亦面临巨大挑战。2004年至2016年间,HIV/AIDS发病率、死亡率和新增HIV感染率持续增长(2004年分别为0.235/10万、0.057/100万和1.020/10万,2016年分别为3.990/10万、1.034/100万和6.442/10万)[6]。
2016年,我国孕产妇感染率为34.0/10万,地区分布差异显著,呈现南高北低、西高东低的特点,新疆中西部地区和云南及毗邻地区孕产妇HIV感染高发(183.6/10万)[7]。
2003年我国开始执行HIV母婴传播防治计划,取得了巨大成功,但仍面临诸多考验,一项荟萃分析显示,2005年至2014年我国仅38.6%的HIV感染孕产妇在产前接受了ART治疗[8]。目前这个比例仍不断提高。
二、 HIV母婴阻断用药现状
不论血浆HIV RNA拷贝数或CD4+ T淋巴细胞计数情况如何,所有HIV感染孕妇应在妊娠期尽早启动ART,以预防围产期母婴传播[1]。目前国内外指南均要求联合使用抗病毒药物预防HIV母婴传播,效果良好[1, 9]。王奇等[10]的研究表明,接受单一药物或联合药物治疗的HIV感染孕产妇母婴传播率分别为2.49%和2.26%,远远低于未应用抗病毒药物者(10.69%)。ART治疗时间越晚,HIV母婴传播风险越高[3]。国内研究也显示,在孕早期和孕中期应用ART预防HIV母婴传播的效果优于孕晚期[11]。因此,对于HIV感染孕妇应尽早使用抗病毒药物[12]。
目前国内共有5大类ARV药物,分别为核苷类反转录酶抑制剂(nucleoside reverse transcriptase inhibitors,NRTIs)、非核苷类反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTIs)、蛋白酶抑制剂(protease inhibitors, PIs)、整合酶抑制剂即整合酶链转移反应抑制剂(integrase strandtransfer inhibitors, INSTIs)和融合抑制剂(fusion inhibitors, FIs)[1]。在为孕产妇选择ART方案时,必须考虑多方面因素,包括不良反应、药物相互作用、药代动力学、单用药物和组合药物患者的依从性、妊娠期间药物使用经验以及患者耐药性检测结果和合并症等[9]。
针对妊娠晚期才来就诊和确诊的HIV感染患者,国内尚缺乏相应用药指导。2018版的《中国艾滋病诊疗指南》指出,对于HIV感染孕妇,首选方案为2种NRTIs+拉替拉韦(raltegravir,RAL)或洛匹那韦(lopinavir,LPV)/利托那韦(ritonavir,r);替代方案为2种NRTIs+多替拉韦(dolutegravir,DTG)或依非韦伦(efavirenz,EFV)或利匹韦林(rilpivirine,RPV)或奈韦拉平(nevirapine,NVP),并未对不同妊娠时期的ART用药进行详细划分[1]。国外指南推荐亦较少,2019年世界卫生组织(World Health Organization,WHO)指南指出,孕妇首选2种NRTIs+DTG[13]。美国卫生与人类服务部(Department of Health and Human Services,DHHS)指南对于妊娠晚期孕产妇推荐使用DTG+阿巴卡韦(ABC)+拉米夫定(3TC)[9]。HIV感染孕产妇ART方案见表1[1]。
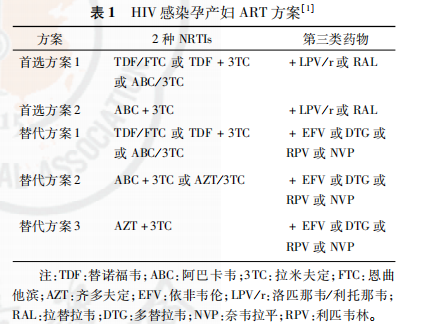
需注意的是,ABC用于HLA-B*5701阴性者。2019 WHO指南指出,孕期使用DTG预期获益大于风险,如果已充分告知DTG的潜在神经管畸形风险(从受孕时至12周末),可以为有生育需求的女性处方DTG[13];
2019年DHHS指南指出,不应为下列人群处方DTG:怀孕12周内的孕妇,有生育潜力并计划怀孕的人,有生育潜力、性活跃且不使用有效避孕措施的人[9];
RPV仅用于病毒载量<105拷贝/ml和CD4+T淋巴细胞>200个/μl的患者;
对于基线CD4+T淋巴细胞>250个/μl的患者要尽量避免使用含NVP的治疗方案,合并丙型肝炎病毒感染的避免使用含NVP的方案。
以RAL、DTG为代表的INSTIs类药物为新型抗HIV的治疗药物,均可通过阻断HIV病毒DNA的链转移反应,从而抑制HIV的复制[14]。INSTIs类药物高效低毒的特点,在HIV感染孕产妇中应用广泛。RAL是2007年第一个被美国食品药品管理局(Food and Drug Administration,FDA)批准上市的HIV INSTIs,DTG于2013年在美国获批上市。
三、妊娠晚期HIV母婴阻断情况
妊娠晚期ART的目标,是尽可能快速降低孕妇的HIV载量,确保分娩时HIV载量检测不到,以减少母婴传播的风险,同时需兼顾药物对胎儿的安全性。此外,在妊娠晚期选择药物时,还需关注孕妇的药物暴露浓度、脐带血药物浓度及新生儿药物洗脱等问题[1, 9]。
/ 1. 孕妇的药物暴露浓度 /
绝大部分抗HIV药物在妊娠晚期暴露浓度较产后低,因而可能增加将HIV传染给婴儿以及母亲产生耐药性突变的风险。孕妇的药物暴露浓度改变可能与孕妇血容量增加、胎儿增加药物分配等原因有关[13-14]。
PIs类药物在孕期血浆浓度降低,对于接受达芦那韦每日一次给药的孕妇,与产后相比,患者孕中和孕晚期药时曲线面积分别降低38%和39%,峰浓度分别降低17%和29%[15]。
RAL和DTG也存在孕期暴露量下降现象,但由于INSTIs类药物易于透过胎盘及新生儿代谢清除较慢等原因,不必增加用药剂量[16-17]。
/ 2. 脐带血药物浓度 /
由于妊娠期间的特殊生理变化,可能会影响母体药物转运蛋白的表达,从而影响穿过胎盘的ARV药物浓度;相对于母体血浆浓度比例,不同抗HIV药物在脐带血中的浓度高低不一[18]。
与母体血浆浓度相比,INSTIs类药物RAL和DTG在脐带血中的浓度比率均高达121%,因而对HIV的母婴阻断效果可能较其他类型药物更优[17, 19]。
美国DHHS指南推荐使用的三种抗HIV药物(DTG、ABC、3TC)就是基于以上特点[9]。
/ 3. 新生儿抗HIV药物洗脱情况 /
尿苷二磷酸葡萄糖醛酸转移酶1A1(uridine diphosphate-glucuronosyltransferase 1A1,UGT1A1)的活性与年龄相关,新生儿UGT1A1活性显著低于成人[20-21]。
RAL和DTG主要经UGT1A1代谢,研究显示,新生儿RAL的中位T1/2为26.6 h(成人中位T1/2通常为9 h),DTG的中位T1/2为32.8 h(成人中位T1/2通常为14 h),RAL和DTG在新生儿中洗脱明显延迟,也显示出其在HIV母婴阻断中的优势[22-23]。
INSTIs类药物中的艾维雷韦(elvitegravir,EVG)因主要通过CYP 3A 酶代谢,中位T1/2与成年人数据基本相同,不具有新生儿洗脱延迟的现象[24]。
/ 4. INSTIs类药物的临床研究 /
目前,关于HIV妊娠晚期快速阻断用药的研究较少,现有证据显示INSTIs类药物在妊娠晚期ART中疗效显著。
一项纳入101名HIV感染孕妇的回顾性队列研究显示,与不含INSTIs的ART方案相比,对于妊娠晚期或初次治疗失败的患者,包含INSTIs的ART方案可迅速缩短病毒载量下降1个log10的时间(35 d vs 8 d,P<0.01),RAL的使用与病毒载量的快速下降有关[25]。Ⅲ期开放标签随机试验DolPHIN-2研究比较了妊娠晚期孕妇使用INSTIs类药物DTG与NNRTIs类药物依非韦伦(EFV)的疗效差异。该研究共纳入268例来自南非和乌干达的患者,在妊娠28周时分别给予2NRTIs+DTG或2NRTIs+EFV进行ART治疗,两组方案均耐受良好,至分娩时均达到HIV-1 RNA<1000 c/ml的比例分别为83%和93%(RR=1.11,95%CI 1.00~1.23),达到HIV-1 RNA<50 c/ml的患者比例分别为43%和74%(RR=1.66,95%CI 1.32~2.09),达到HIV-1 RNA<50 c/ml的中位时间为82 d和28 d[26]。
Brites等[27]比较了妊娠晚期孕妇使用RAL和PIs类药物LPV/r的疗效及安全性差异。与LPV/r相比,RAL降低孕妇病毒载量的速度更快(2周 6% vs 41%;4周 15% vs 43%;6周 20% vs 100%),同时RAL的不良反应更少,安全性更好(62.5% vs 23.5%,P=0.03)[27]。
由此可见,INSTIs类药物可迅速降低妊娠晚期的病毒载量,从而有利于HIV母婴传播的快速阻断。
若女性患者的随访开始较晚,于妊娠的中期或晚期开始,可优先选择含整合酶抑制剂的ART方案[28];若HIV载量在妊娠晚期仍然可以检测到,应实施耐药测试,如果尚未使用整合酶抑制剂的话,考虑改为或增加整合酶抑制剂(RAL或DTG),以达到HIV载量的快速下降。
但是,EVG和Bictegravir(BIC)目前没有在妊娠期使用的安全性数据,各指南均没有推荐使用。
消除艾滋病母婴传播是“健康中国2030”的核心目标,临床上常有部分HIV感染孕妇直到妊娠晚期或临产前才来就诊,需要进行抗病毒治疗快速阻断母婴传播。目前关于HIV孕妇妊娠晚期快速母婴阻断用药报道较少,现有数据显示,INSTIs药物因为具有在脐带血浓度高、新生儿洗脱明显延迟、抗病毒效果较强、胎儿安全级别较高等特点,在孕妇中的使用越来越受到重视。
上下滑动查看参考文献
[2] Zeng H, Chow EP, Zhao Y, et al. Prevention of mother-to-child HIV transmission cascade in China: a systematic review and meta-analysis[J]. Sex Transm Infect, 2016, 92(2):116-123.
[3] Meyers K, Qian H, Wu Y, et al. Early Initiation of ARV During Pregnancy to Move towards Virtual Elimination of Mother-to-Child-Transmission of HIV-1 in Yunnan, China[J]. PLoS One, 2015, 10(9):e0138104.
[4] GBD 2017 HIV collaborators. Global, regional, and national incidence, prevalence, and mortality of HIV, 1980-2017, and forecasts to 2030, for 195 countries and territories: a systematic analysis for the Global Burden of Diseases, Injuries, and Risk Factors Study 2017[J]. Lancet HIV, 2019, 6(12):e831-e859.
[5] Unaids. Global HIV & AIDS statistics—2020 fact sheet[EB/OL]. (2020-05-06)[2020-05-06].https://www.unaids.org/sites/default/files/media_asset/UNAIDS_FactSheet_en.pdf
[6] Qiao YC, Xu Y, Jiang DX, et al. Epidemiological analyses of regional and age differences of HIV/AIDS prevalence in China, 2004-2016[J]. Int J Infect Dis, 2019, 81:215-220.
[7] 姜金茹,周玉博,李宏田,等.2016年中国孕产妇艾滋病病毒感染空间分布特征[J]. 中华医学杂志,2018,98(41):3360-3364.
[8] Huang Z, Jin M, Zhou H, et al. The Uptake of Prevention of Mother-to-Child HIV Transmission Programs in China: A Systematic Review and Meta-Analysis[J]. PLoS One, 2015, 10(8):e0135068.
[9] Panel on treatment of pregnant women with HIV infection and prevention of perinatal transmission. Recommendations for the Use of Antiretroviral Drugs in Pregnant Women with HIV Infection and Interventions to Reduce Perinatal HIV Transmission in the United States[EB/OL](2019-12-24)[2020-05-06].
https://clinicalinfo.hiv.gov/sites/default/files/inline-files/PerinatalGL.pdf.
[10] 王奇,司珩,马彦民,等.河南省2002-2014年预防艾滋病母婴传播干预工作效果研究[J]. 河南医学研究,2017,26(9):1537-1540.
[11] 刘冬梅,秦燕,韦丹燕,等.不同孕周高效抗反转录病毒治疗对HIV母婴阻断效果的比较[J]. 中国临床新医学,2016,9(9):770-772.
[12] Wang Q, Wang L, Fang L, et al. Timely antiretroviral prophylaxis during pregnancy effectively reduces HIV mother-to-child transmission in eight counties in China: a prospective study during 2004-2011[J]. Sci Rep, 2016, 6(1):34526.
[13] Pariente G, Leibson T, Carls A, et al. Pregnancy-Associated Changes in Pharmacokinetics: A Systematic Review[J]. PLoS Med, 2016, 13(11):e1002160.
[14] Costantine MM. Physiologic and pharmacokinetic changes in Pregnancy[J]. Front Pharmacol, 2014, 5:65.
[15] Stek A, Best BM, Wang J, et al. Pharmacokinetics of Once Versus Twice Daily Darunavir in Pregnant HIV-Infected Women[J]. J Acquir Immune Defic Syndr, 2015, 70(1):33-41.
[16] Watts DH, Stek A, Best BM, et al. Raltegravir pharmacokinetics during pregnancy[J]. J Acquir Immune Defic Syndr, 2014, 67(4):375-381.
[17] Waitt C, Orrell C, Walimbwa S, et al. Safety and pharmacokinetics of dolutegravir in pregnant mothers with HIV infection and their neonates: A randomised trial (DolPHIN-1 study)[J]. PLoS Med, 2019, 16(9):e1002895.
[18] Hodel EM, Marzolini C, Waitt C, et al. Pharmacokinetics, Placental and Breast Milk Transfer of Antiretroviral Drugs in Pregnant and Lactating Women Living with HIV[J]. Curr Pharm Des, 2019, 25 (5):556-576.
[19] Blonk MI, Colbers APH, Hidalgo-Tenorio C, et al. Raltegravir in HIV-1-Infected Pregnant Women: Pharmacokinetics, Safety, and Efficacy[J]. Clinical Infectious Diseases, 2015, 61(5):809-816.
[20] Bhatt DK, Mehrotra A, Gaedigk A, et al. Age- and Genotype-Dependent Variability in the Protein Abundance and Activity of Six Major Uridine Diphosphate-Glucuronosyltransferases in Human Liver[J]. Clin Pharmacol Ther, 2019, 105(1):131-141.
[21] Neumann E, Mehboob H, Ramírez J, et al. Age-Dependent Hepatic
UDP-Glucuronosyltransferase Gene Expression and Activity in Children[J]. Front Pharmacol, 2016, 7:437.
[22] Clarke DF, Acosta EP, Rizk ML, et al. Raltegravir pharmacokinetics in neonates following maternal dosing[J]. J Acquir Immune Defic Syndr, 2014, 67(3):310-315.
[23] Mulligan N, Best BM, Wang J, et al. Dolutegravir pharmacokinetics in pregnant and postpartum women living with HIV[J]. Aids, 2018, 32:729-737.
[24] Momper JD, Best BM, Wang J, et al. Elvitegravir/cobicistat pharmacokinetics in pregnant and postpartum women with HIV[J]. Aids, 2018, 32(6):2507-2516.
[25] Rahangdale L, Cates J, Potter J, et al. Integrase inhibitors in late pregnancy and rapid HIV viral load reduction[J]. Am J Obstet Gynecol, 2016, 214(3):385.e381-387.
[26] Kintu K, Malaba TR, Nakibuka J, et al. Dolutegravir versus efavirenz in women starting HIV therapy in late pregnancy (DolPHIN-2): an open-label,randomised controlled trial[J]. Lancet HIV. 2020, 7(5): e332-e339.
[27] Brites C, Nobrega I, Luz E, et al. Raltegravir versus lopinavir/ritonavir for treatment of HIV-infected late-presenting pregnant women[J]. HIV Clin Trials, 2018, 19(3):94-100.
[28] 中华医学会热带病与寄生虫学分会艾滋病学组,中华医学会感染病学分会艾滋病学组.整合酶抑制剂临床应用专家共识[J]. 上海医药,2018,39(23):19-26,59.
应若素, 李芳. 人类免疫缺陷病毒感染孕妇妊娠晚期快速母婴阻断抗病毒治疗[J/CD]. 中华产科急救电子杂志,2020,9(4): 195-198.
