中华医学会
地址: 中国北京东四西大街42号
邮编: 100710
母婴同室早发感染高危新生儿临床管理专家共识(含管理流程图)
本文引用格式: 中国妇幼保健协会新生儿保健专业委员会, 中国医师协会新生儿科医师分会. 母婴同室早发感染高危新生儿临床管理专家共识[J] . 中华围产医学杂志, 2021, 24(8) : 567-575. DOI:10.3760/cma.j.cn113903-20210310-00202
中国妇幼保健协会新生儿保健专业委员会
中国医师协会新生儿科医师分会
通信作者:吴明远,浙江大学医学院附属妇产科医院新生儿科,杭州 310006,Email:wumy@163.com,电话:0571-87061501;封志纯,解放军总医院儿科医学部,北京 100700,Email:zhjfengzc@126.com,电话:010-64063099;杨杰,广东省妇幼保健院新生儿科,广州 511400,Email:jieyang0830@163.com,电话:020-39151600
摘 要
新生儿早发感染(early-onset neonatal infection, EONI)是威胁新生儿生命健康的严重疾病,多种产科因素可增加EONI风险,如何管理EONI高危新生儿,既能有效预防和治疗EONI,又能尽量减少抗生素应用,是产科和新生儿科面临的巨大挑战。中国妇幼保健协会新生儿保健专业委员会和中国医师协会新生儿科医师分会组织成立专家组,通过文献检索和分析讨论形成具有证据等级的共识草案,并采用德尔菲法对各条共识进行匿名专家调查反馈及投票,制定了此共识。共识强调了产科和儿科间信息沟通和密切临床观察对EONI早期识别和防治的重要性。同时建议所有EONI高危新生儿应留院严密观察至少48 h;若新生儿出现感染症状,或新生儿无感染症状但存在母亲绒毛膜羊膜炎或侵袭性细菌感染,或同时存在≥2项高危因素包括母亲产时发热≥38 ℃、B族链球菌定植、胎膜早破≥18 h以及自发性早产时,建议转新生儿科进一步评价并预防性使用抗生素。
【关键词】 细菌感染;母婴同室;危险因素;新生儿护理;抗生素预防;共识
新生儿早发感染(early-onset neonatal infection, EONI)主要指生后72 h内发生的细菌感染,总体发生率较低,但一旦发病,通常起病急、进展快,严重者可出现多脏器衰竭、后遗症甚至死亡。通过产科高危因素筛查及产时抗生素预防(intrapartum antibiotics prophylaxis, IAP),能使B族链球菌(group B Streptococcus, GBS)所致EONI的发生率下降约80%[1],是预防GBS-EONI的主要手段。对EONI高危新生儿选择性抗生素预防,以及对有疑似感染症状的新生儿经验性抗生素治疗,可进一步降低EONI发生率和致残致死率。
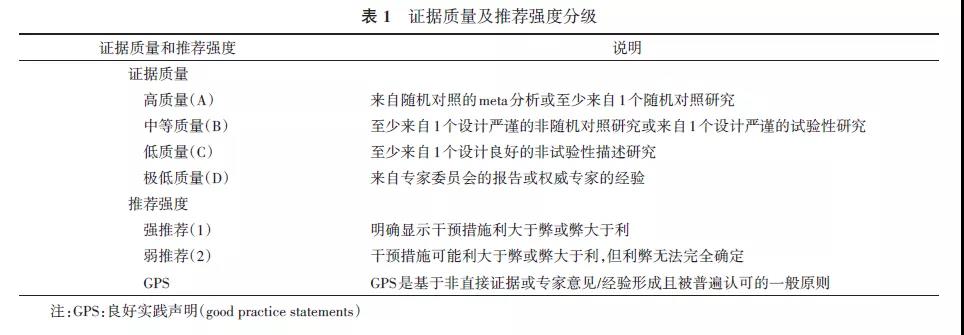
国外多家权威机构如美国疾病预防控制中心(Centers for Disease Control, CDC)、美国儿科学会(American Academy of Pediatrics, AAP)、英国国立健康与临床优化研究所(National Institute for Health and Clinical Excellence, NICE)均制定了针对早发型GBS感染的防治指南[1-3],我国也制定了新生儿败血症诊断及治疗专家共识[4],但缺乏针对母婴同室EONI高危新生儿管理方式的共识,各地的管理和预防策略也不尽一致。因此,中国妇幼保健协会新生儿保健专业委员会和中国医师协会新生儿科医师分会组织成立共识制定专家组,通过文献检索和分析讨论形成具有证据等级的共识草案,根据评估、制订和评价(grades of recommendation, assessment, development, and evaluation, GRADE)方法,对证据质量和推荐强度进行分级(表1)。由于该领域缺少高质量前瞻性对照研究,专家组通过德尔菲法对各条建议进行匿名调查反馈及投票,最终投票意见分5个等级(很同意、同意、一般、不同意、很不同意),共识率=(很同意+同意)人数/被调查反馈专家人数×100%,便于临床决策时参考(本共识被调查反馈专家人数为28人)。本共识适用于各级妇幼保健机构产科和新生儿科(儿科)医护人员,主要针对产房和母婴同室EONI高危新生儿的临床管理,目的是既有效预防EONI的发生或不良结局,又减少不必要的抗生素使用和母婴分离。
一、EONI的特点和流行病学
EONI主要表现为早发败血症(early onset sepsis, EOS),少部分表现为或合并有肺炎、脑膜炎。90%以上生后24 h内出现临床表现,包括体温不稳定、嗜睡、喂养困难、心动过速、呼吸暂停/心动过缓、呼吸窘迫、需要用氧或呼吸支持、严重心肺功能衰竭、持续性肺动脉高压以及新生儿脑病症状等。因有极少数患儿在出生3 d后发病,美国CDC将生后7 d内发生的GBS感染均纳入早发感染范畴[1]。常见致病菌为GBS和大肠埃希菌,其他包括肺炎克雷伯菌、草绿色链球菌、金黄色葡萄球菌、肠球菌等,单核细胞增多性李斯特菌所致感染少见,但发病凶险、病死率高。
自2002年美国CDC推荐孕晚期GBS普查并实施针对GBS的IAP以来,大部分国家的EONI发生率明显降低。美国国家儿童健康与人类发展研究所对2006年至2009年约40万名活产新生儿的前瞻性研究显示,经血液或脑脊液培养确诊的EONI发生率为0.98/1 000活产儿,其中GBS感染占43%,大肠埃希菌感染占29%;GBS感染更多见于足月儿(占73%),而大肠埃希菌感染多见于早产儿(占81%)[5]。近年来我国多项大样本研究显示,经血液和脑脊液培养证实的早发型GBS感染发生率为(0.39~0.40)/1 000活产儿,病死率为6.45%~8.2%,神经系统后遗症发生率为4.1%[6-7],但我国不同胎龄及不同致病菌所致EONI发生率、死亡率以及后遗症发生率的数据仍然十分有限。
除母亲高危因素外,新生儿胎龄和症状是预测EONI发病风险的两大要素。早产儿或有疑似临床症状者发病率高,而无任何临床症状的足月儿发病率极低。有研究表明,胎龄≥37周新生儿48 h内EOS总发病率仅为0.5/1 000活产儿,而<37周者EOS发病率增加了5~6倍;在胎龄≥34周且生后12 h内无任何症状的新生儿,其EOS发生风险较群体发病率下降60%~70%[8-9]。
二、产科、新生儿科、家属之间的信息沟通
【推荐1】 产科应将EONI高危因素及IAP情况记录在案,通过合适机制确保产科和新生儿科医护人员及时信息共享,有关信息及处理方案应及时与家属沟通。(GPS)
目前公认的EONI高危因素包括母亲绒毛膜羊膜炎(chorioamnionitis, CAM)或产时发热、GBS定植或菌尿症或既往新生儿GBS感染、胎膜早破(premature rupture of membrane, PROM)≥18 h、自发性早产。虽然单纯以产科高危因素预测EONI的可靠性较低[10-11],但产科与新生儿科间保持及时通畅的信息沟通,有助于对这些高危新生儿进行个体化和动态化管理,有助于决定新生儿观察方法、辅助检查、家属沟通以及是否预防性使用抗生素,对降低EONI发生率、预防EONI不良结局以及防止医患纠纷均十分重要。
三、临床观察在EONI防治中的地位
【推荐2】 对母婴同室EONI高危新生儿,应严密观察至少48 h,一旦出现疑似感染症状,应立即全面体格检查和评估,必要时及时转送新生儿科。(GPS)
大量研究证明,早发感染的新生儿,临床表现的灵敏度高于外周血白细胞(white blood cell, WBC)计数,且90%以上EONI生后24 h内出现症状,极少数出生3 d后发病,无症状感染的发生率极低[10,12-13]。因此,对所有EONI高危新生儿应留院严密观察至少48 h[14],建议每次喂奶前后或至少每3~4 h观察并记录呼吸状况、体温、精神、反应、肌张力、哺乳及肤色等指标。若发现气促、吸气性三凹征、呻吟、呼吸暂停、青紫、无法用环境因素解释的体温异常、末梢循环不良、无法解释的心动过速或心动过缓、精神萎靡、哭声弱或不易安慰的啼哭、反应差或激惹、抽搐、肌张力改变、哺乳差、明显呕吐等症状[15-19],应及时转送新生儿科检查并使用抗生素(图1)。
新生儿感染的临床表现缺乏特异性,早期难以与其他疾病或过渡期表现相鉴别。如出生后早期轻微呼吸窘迫,可能为EONI症状,或可能因保暖不当所致,或为呼吸、循环、血液系统疾病的早期表现,也可能为正常过渡表现,后者症状通常4~6 h内消失。体温降低和末梢循环不良可能为EONI的临床表现,也可能因保暖不当所致,后者通常有保暖不当史并在保暖后很快恢复。因此,当新生儿出现疑似感染症状时,应由新生儿科或儿科医生全面复习病史、体格检查并综合评价,必要时及时转送新生儿科。
【推荐3】 应不断加强对产科和新生儿科医护人员的专业培训以及常态化的家属宣教,提高对母婴同室新生儿常见症状的识别能力。(GPS)
虽然有EONI高危因素的新生儿感染发病率增加,但在产科IAP背景下,EONI的总体发病率较低。相反,如果未行产前GBS筛查,或因检测本身局限性,即使无已知高危因素,新生儿也存在EONI发病风险。因此,需要不断加强对产科和新生儿科医护人员的业务培训以及对家属的常态化健康宣教,严格执行母婴同室医疗护理制度,不断提升对母婴同室新生儿常见症状的识别能力,及早发现和治疗EONI,预防和减少EONI后遗症或死亡。
四、基于产科高危因素的母婴同室新生儿管理
对于有产科高危因素但无临床症状的母婴同室新生儿,是否预防性使用抗生素,是否需要转入新生儿病房,是否进行辅助检查,需根据产科高危因素种类、数量、程度、胎龄等因素综合分析和决定(图1)。如何既有效预防发病和不良结局,同时减少不必要的抗生素使用及母婴分离,仍在不断探索和优化中。
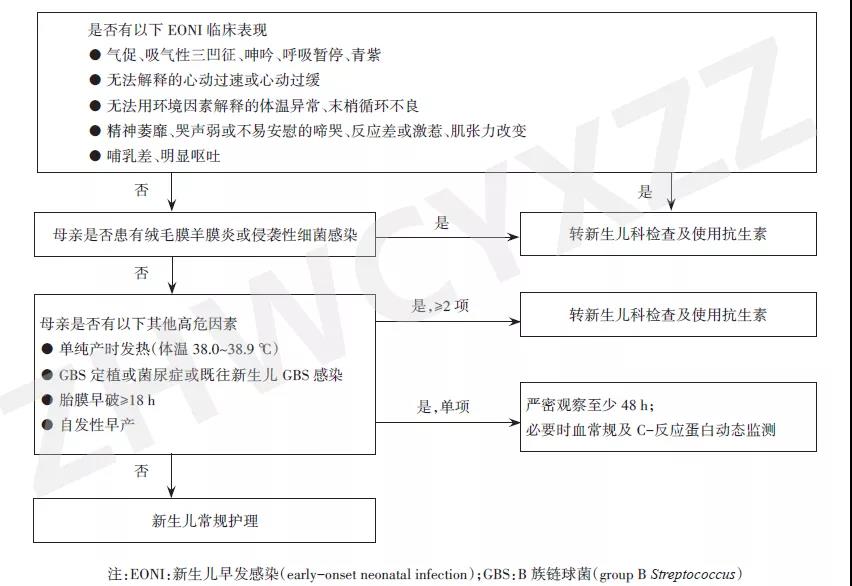
图1母婴同室EONI高危新生儿管理流程
(一)母亲CAM或侵袭性细菌感染
【推荐4】 母亲CAM或其他侵袭性细菌感染(如败血症)是胎儿感染的最主要高危因素,无论新生儿胎龄及IAP情况,建议转新生儿科检查并预防性使用抗生素[2,4,20]。(推荐等级2D,共识率92%)
母亲CAM是公认的EOS高危因素,主要致病菌为大肠埃希菌和GBS[21],其他包括阴道加德纳菌、拟杆菌以及生殖道支原体等。由于CAM常涉及羊水、胎儿、脐带或胎盘的感染,临床上也常称羊膜腔感染(intra-amniotic infection, IAI)。传统的临床CAM诊断标准为产妇体温≥38.0 ℃且合并至少有下列2项表现[22]:(1)脉搏增快(>100次/min);(2)胎心率增快(>160次/min);(3)宫底压痛;(4)羊水臭味或脓性;(5)外周WBC计数升高(>15×109/L)或核左移。如果羊水或宫腔分泌物培养阳性,可诊断微生物学CAM。如果镜检胎盘胎膜发现组织内粒细胞浸润,可诊断组织学CAM。当怀疑或诊断CAM时,产科常规实施IAP。
虽然产科IAP可降低CAM所致新生儿EOS发生率,但其预防效果低于针对GBS的产时预防,故多数指南或共识建议,无论CAM母亲是否接受IAP,新生儿应常规预防性使用抗生素。该策略的合理性近年来出现争议,因有越来越多的研究显示,母亲CAM所致EONI的总体发病率仍然较低。有研究显示,1 892例≥35周CAM母亲分娩的新生儿中,仅15例(0.8%)血培养阳性[23]。对CAM或疑似CAM母亲分娩的新生儿常规预防性使用抗生素,会导致大量新生儿接受不必要的抗生素使用及母婴分离。鉴于CAM诊断的不确定性及EONI的危害性,本共识仍推荐在产科诊断CAM情况下对新生儿进行血培养、血常规、C-反应蛋白(C-reactive protein, CRP)等感染相关检查并预防性使用抗生素。
母亲产前或产时败血症或菌血症较为少见,但细菌可通过血流经胎盘侵入胎儿,EONI风险明显增加。因此,如果母亲在分娩前后因侵袭性细菌感染而使用抗生素,建议对新生儿进行感染相关检查并预防性使用抗生素[3]。
(二)产时发热
【推荐5】 若母亲产时发热不伴其他感染证据,新生儿应严密观察至少48 h。若考虑CAM或其他侵袭性细菌感染,或合并其他高危因素如GBS定植或菌尿症、GBS定植状况不明但存在既往新生儿GBS感染史、PROM≥18 h、自发性早产,建议转新生儿科检查并预防性使用抗生素。(推荐等级2D,共识率100%)
产时发热的总体发生率为6.8%~9%[24-25],最常见的原因为CAM和椎管内麻醉,其他包括产程延长、环境温度过高、呼吸道及其他部位感染。由于CAM的症状和实验室检查结果异常可能不典型,其临床诊断标准并不统一,除上述传统标准外,有些将产时发热作为CAM的唯一诊断依据[26],有些建议在母亲产时发热≥39 ℃,或38.0~38.9 ℃合并≥1项其他感染证据时疑似CAM,而将体温38.0~38.9 ℃但不合并其他感染证据的产时发热称为单纯产时发热[27-28]。在无法排除感染情况下,对产时发热孕妇实施IAP是产科常见方法。
虽然产时发热是公认的EONI高危因素,可使新生儿EOS发生率增加4.5倍以上[29],但EOS的总体发生率仍然较低。研究显示,在IAP前提下,母亲产时发热导致新生儿EOS的发生率仅为0.14%~0.72%[25,30-31]。如果能明确母亲产时发热是因接受椎管内麻醉或产程延长所致,未有其他感染证据,新生儿则无需预防性使用抗生素。但由于椎管内麻醉会掩盖CAM症状,或CAM母亲对疼痛敏感性增加而更倾向于要求无痛分娩,即使考虑无痛分娩导致发热,仍难以完全排除CAM。因此,对产时发热母亲的新生儿严密观察至少48 h是最基本的管理措施;若产科诊断CAM,或合并其他高危因素如GBS定植或菌尿症、GBS定植状况不明但存在既往新生儿GBS感染史、PROM≥18 h以及自发性早产,建议对新生儿进一步检查并预防性使用抗生素。
(三)GBS定植或菌尿症
【推荐6】 对母亲GBS筛查阳性的无症状新生儿无需常规预防性使用抗生素,但需严密观察至少48 h,特别是未接受充分IAP的新生儿。若合并PROM≥18 h、产时发热≥38 ℃、自发性早产等高危因素,建议转新生儿科进一步检查并预防性使用抗生素。(推荐等级2D,共识率96%)
母亲直肠或阴道GBS定植或菌尿症是公认的GBS-EOS独立高危因素。破膜后或分娩过程中,GBS定植孕妇将细菌传递给新生儿的发生率约50%,在未行IAP情况下,1%~2%的新生儿会发生GBS早发感染[32]。我国报道的GBS定植率差异较大(3.5%~32.4%)[6,33],可能与取材部位、检测方法及筛查孕周不同有关。研究表明,孕35周+0~37周+6筛查阴性者,仍有约10%在产时呈阳性[34]。美国妇产科医师学会(American College of Obstetricians and Gynecologists, ACOG)最新推荐孕36周+0~37周+6筛查,能更可靠地预测孕妇产时GBS定植状况[35]。
研究表明,产前GBS筛查并实施IAP是预防新生儿GBS-EOS的有效手段[1]。产科IAP的具体措施包括:(1)孕35周+0~37周+6培养法筛查或产前聚合酶链反应筛查,对筛查阳性者,在分娩前至少4 h开始静脉注射抗生素,首选青霉素G(或氨苄青霉素),青霉素轻度过敏者使用一代头孢菌素(如头孢唑啉),青霉素严重过敏者使用万古霉素或在药敏试验确认敏感后使用克林霉素。凡用药后不足4 h出生,或未使用上述抗生素预防者,均属预防不充分。(2)如果孕妇没有破膜且择期剖宫产,即使筛查阳性也无需IAP。(3)如果未行孕晚期或产前GBS筛查,符合以下任一项指征者也需实施IAP[20]:①既往妊娠期GBS阳性或新生儿GBS感染史;②本次妊娠期GBS菌尿症;③<37周先兆早产;④PROM≥18 h;⑤产时发热≥38 ℃。
如果母亲GBS阳性已接受充分IAP,新生儿无临床症状,无其他高危因素,其感染风险极低,但仍需母婴同室观察至少48 h后出院;如果母亲没有破膜或CAM证据且剖宫产,新生儿可按常规护理。
如果母亲GBS阳性未接受IAP或IAP不充分,包括早产儿在内的新生儿GBS-EOS群体发病风险为1%~2%,而对于无症状的晚期早产儿和足月新生儿,其发病风险低于1%。有报道发现在母亲GBS阳性但未接受IAP或IAP不充分的3 101例新生儿中,仅2例(0.06%)确诊GBS-EOS,均在生后24 h内出现症状[23]。因此,对该类高危新生儿不建议常规预防性使用抗生素,但应在生后全面体格检查、留院密切观察至少48 h,并对父母加强健康宣教。
如果母亲GBS定植合并其他高危因素,无论是否接受IAP,新生儿感染风险均高于母亲单纯GBS定植时的风险[29]。根据伴发高危因素的数量和程度、IAP情况以及新生儿临床表现,采取个体化评估和处理是较为理想的策略,能有效预防感染及不良结局,同时最大程度减少不必要的抗生素使用。鉴于目前尚无确切有效的综合评估方法,本共识推荐在母亲GBS定植合并其他EONI高危因素(包括PROM≥18 h、产时发热≥38 ℃、自发性早产等)时,对新生儿进一步检查并预防性使用抗生素。
(四)PROM及破膜时间延长[36-37]
【推荐7】 若PROM≥18 h,无症状足月新生儿无需常规预防性使用抗生素,但需严密观察至少48 h,若合并其他高危因素(如母亲GBS定植或菌尿症或既往新生儿GBS感染史、产时发热≥38 ℃),或未足月PROM(preterm PROM,PPROM)≥18 h,建议转新生儿科进一步检查并预防性使用抗生素[3]。(推荐等级2D,共识率100%)
PROM是指临产前发生胎膜破裂。足月PROM通常是即将临产的征兆,在胎膜破裂后12 h内、12~24 h、24~72 h内自行临产的比例分别为50%、20%、25%,72 h内仍不能临产者约占5%。PPROM通常因CAM或多胎等因素所致,即使经积极保胎处理,仍有约50%在破膜后1周内分娩,是早产的主要原因。产科通常对PPROM、或足月PROM伴潜伏期>12 h者实施IAP。对于晚期PPROM和足月PROM,在充分评估母胎状况后,通常对无剖宫产指征者在破膜后2~12 h内积极引产,以缩短破膜至分娩的时间,降低CAM风险[36]。
PROM≥18 h和PPROM是公认的EONI高危因素,破膜时间越长,胎龄越小,风险越大。对于无任何症状的足月新生儿,PROM所致EONI的总体发生率很低,一般不建议常规预防性使用抗生素,以减少不必要的抗生素暴露,但需密切观察至少48 h。对PPROM≥18 h的无症状晚期早产儿是否预防性使用抗生素尚存在争论,或建议按疑似感染处理[4],或可以采用与足月儿相似的管理方式,无需常规预防性使用抗生素[23]。在缺乏确切有效的评价方法指导个体化检查和治疗情况下,本共识建议在足月PROM≥18 h合并至少1项其他EONI高危因素(包括母亲GBS定植或菌尿症或既往新生儿GBS感染史、产时发热≥38 ℃),或PPROM≥18 h时,对新生儿进一步评价并预防性使用抗生素。
(五)早产
【推荐8】 若明确因多胎、羊水过多、母亲妊娠高血压等非感染因素所致早产,早产儿无需预防性使用抗生素。若自发性早产合并其他高危因素(如母亲GBS定植或菌尿症、本次GBS状况不明但存在既往新生儿GBS感染史、PPROM≥18 h、产时发热≥38 ℃),应转新生儿科检查并预防性使用抗生素。(推荐等级2D,共识率100%)
自发性早产通常与CAM和PPROM有关,是公认的感染高危因素。胎龄越小,感染风险越高。产科对先兆早产孕妇是否常规IAP仍有争论,一般认为如果胎膜完整且无感染证据或择期剖宫产,使用抗生素不能预防早产和改善预后;但如果即将分娩且生殖道GBS筛查阳性或未筛查,需实施IAP[20,36,38]。
由于早产与感染关系密切,对任何早产儿需了解和分析早产原因。如果明确早产由非感染因素所致(如多胎、羊水过多、妊娠高血压等),或没有合并其他EONI高危因素,无需预防性使用抗生素。如果自发性早产原因不明,应严密观察至少48 h。若自发性早产合并其他EONI高危因素,包括母亲GBS定植或菌尿症、本次GBS状况不明但存在既往新生儿GBS感染史、PPROM≥18 h、产时发热≥38 ℃,早发感染风险会明显增加。胎龄越小、高危因素数量越多、程度越重,感染风险越大。虽然有研究表明对晚期早产儿的处理方案可类似足月儿,但在无法确定个体化最佳方案的情况下,本共识建议在自发性早产合并其他EONI高危因素时转新生儿科检查并预防性使用抗生素。
(六)其他高危因素
【推荐9】 羊水胎粪污染(meconium- stained amniotic fluid, MSAF)可能增加新生儿感染风险,但对无症状新生儿无需常规预防性使用抗生素。(推荐等级1B,共识率96%)
MSAF通常被认为是宫腔感染的高危因素,因胎粪可抑制羊水的抑菌特性,促进细菌生长。然而,越来越多的证据表明,对MSAF母亲及新生儿预防性使用抗生素不能降低新生儿感染发生率[39-41]。Goel等[39]对MSAF新生儿进行随机对照研究,预防性使用抗生素组[静脉注射哌拉西林-他唑巴坦100 mg/(kg•d)和丁胺卡那霉素15 mg/(kg•d)治疗3 d]与未使用抗生素组比较,疑似败血症发生率和血培养确诊败血症发生率差异均无统计学意义,新生儿死亡率、胎粪吸入综合征以及其他并发症发生率差异亦无统计学意义。2017年的Cochrane系统评价认为,对MSAF新生儿特别是无症状者没有必要预防性使用抗生素[40]。因此,本共识不建议对母婴同室无症状的MSAF新生儿预防性使用抗生素。
五、辅助检查及意义
【推荐10】 生后早期非特异性辅助检查(如WBC计数和CRP)对预测或早期诊断EONI意义不大,但动态监测非特异性指标的变化有助于排除诊断或辅助诊断,是预防性使用抗生素后决定停药的重要依据。(推荐等级1C,共识率100%)
尽管将新生儿出生后3 d内WBC计数≥30×109/L和不成熟中性粒细胞/总中性粒细胞≥0.16作为异常,但由于受产前多种因素及分娩应激的影响,新生儿生后白细胞变化较大,无论升高或正常对早发感染的诊断或排除价值均较低。相反,若WBC计数<5×109/L或中性粒细胞绝对计数<1.5×109/L,对诊断EONI具有很高的阳性预测价值。为尽量提高检测价值,一般推荐生后6~12 h行血常规检查[12]。
同样,受多种非感染性炎症、分娩应激、胎儿窘迫、新生儿窒息、胎粪吸入、脑室内出血等影响,生后最初几天CRP升高对早发感染诊断的特异性差[42-43]。相反,生后早期CRP正常也无法排除早发感染,而间隔18~24 h动态监测CRP正常对排除感染有很高的价值。
由于生后早期非特异性辅助检查的灵敏度和特异度不足以早期诊断或预测EONI,临床表现和产科高危因素数量和程度仍然是决定EONI高危新生儿生后早期管理方式的主要依据。在严密临床观察过程中,需根据临床表现、高危因素、实验室检查综合判断。任何仅凭实验数据或仅凭临床及高危因素做出感染诊断都是不够全面的[44-45]。如果无症状新生儿单项非特异性指标轻微升高,允许在综合评估前提下暂时严密观察及动态复查;如果存在感染的临床表现,或存在≥2项非特异性指标升高,或非特异性指标明显偏离正常或动态变化异常,建议转新生儿科按疑似或临床败血症治疗[4]。
六、抗生素的选择、剂量、疗程及途径
【推荐11】 按照规范选择抗生素的种类、剂量及疗程。对于需要使用抗生素的EONI高危新生儿,建议转新生儿科静脉内用药。在资源匮乏地区,肌内注射抗生素可作为预防性用药的备选方案。(推荐等级1B,共识率93%)
不建议将口服抗生素作为母婴同室新生儿预防性用药的常规选择。(推荐等级2D,共识率93%)
新生儿抗生素的选择、剂量和疗程参照我国“新生儿败血症诊断及治疗专家共识(2019年版)”[4]。无论预防性用药还是经验性治疗,均推荐在新生儿病房静脉内用药。由于肌内注射存在肿胀、疼痛、出血、药液外渗、吸收不如静脉等缺点,不推荐在母婴同室常规应用,仅作为资源匮乏地区(如缺乏新生儿病房或新生儿静脉注射技术)对无症状EONI高危新生儿预防性用药的备选方案[46]。虽然口服抗生素可以作为新生儿抗生素阶梯治疗时的考虑选项,但由于新生儿口服抗生素吸收较慢,较晚达到其最大浓度,在目前缺乏足够研究证据情况下,尚不能作为抗生素初始用药的推荐途径[47]。
执笔专家:吴明远(浙江大学医学院附属妇产科医院)、封志纯(解放军总医院儿科医学部)、杨杰(广东省妇幼保健院)
参与本共识讨论和制定的专家(按姓氏拼音排序):曹蓓(湖南省妇幼保健院)、陈超(复旦大学附属儿科医院)、陈冬梅(泉州市妇幼保健院/儿童医院)、封志纯(解放军总医院儿科医学部)、韩树萍(南京医科大学附属妇产医院/南京市妇幼保健院)、黄磊(山东大学附属山东省妇幼保健院)、纪永佳(宁夏回族自治区妇幼保健院)、巨容(成都市妇女儿童中心医院)、李耿(首都医科大学附属北京儿童医院)、李占魁(西北妇女儿童医院)、刘玲(贵阳市妇幼保健院/贵阳市儿童医院)、刘克战(山西省妇幼保健院)、谭春迎(辽宁省妇幼保健院)、唐文燕(江西省妇幼保健院)、田秀英(天津市中心妇产科医院)、王慧琴(安徽省妇幼保健院)、韦秋芬(广西壮族自治区妇幼保健院)、吴高强(新疆维吾尔自治区妇幼保健院)、吴明远(浙江大学医学院附属妇产科医院)、夏世文(湖北省妇幼保健院)、邢燕(北京大学第三医院)、徐韬(中国疾病预防控制中心妇幼保健中心)、徐发林(郑州大学第三附属医院)、杨杰(广东省妇幼保健院)、羊玲(海南省妇幼保健院)、叶秀桢(广东省妇幼保健院)、易彬(甘肃省妇幼保健院/省儿童医学中心)、张雪峰(解放军总医院第五医学中心)、郑军(天津市中心妇产科医院)、钟晓云(重庆市妇幼保健院)
利益冲突 所有作者均声明不存在利益冲突
参考文献
[1] Verani JR, McGee L, Schrag SJ. Preventionof perinatal group B streptococcal disease--revised guidelines from CDC,2010[J]. MMWR Recomm Rep, 2010,59(RR-10):1-36.
[2] Baker CJ, Byington CL, Polin RA. Policystatement—recommendations for the prevention of perinatal group B streptococcal(GBS) disease[J]. Pediatrics, 2011,128(3):611-616. DOI: 10.1542/peds.2011-1466.
[3] Caffrey Osvald E, Prentice P. NICE clinicalguideline: antibiotics for the prevention and treatment of early-onset neonatalinfection[J]. Arch Dis Child Educ Pract Ed, 2014,99(3):98-100. DOI:10.1136/archdischild-2013-304629.
[4] 中华医学会儿科学分会新生儿学组, 中国医师协会新生儿科医师分会感染专业委员会. 新生儿败血症诊断及治疗专家共识(2019年版)[J].中华儿科杂志,2019,57(4):252-257. DOI: 10. 3760/cma.j.issn.0578-1310.2019.04.005.
TheSubspecialty Group of Neonatology, the Society of Pediatric, Chinese MedicalAssociation, Professional Committee ofInfectious Diseases, Neonatology Society, Chinese Medical Doctor Association.Expert consensus on the diagnosis and management of neonatal sepsis (version2019)[J]. Chin J Pediatr, 2019,57(4):252-257.DOI:10.3760/cma.j.issn.0578-1310.2019. 04.005.
[5] Stoll BJ, Hansen NI, Sánchez PJ, et al.Early onset neonatal sepsis: the burden of group B Streptococcal and E. colidisease continues[J]. Pediatrics, 2011,127(5):817-826. DOI:10.1542/peds.2010-2217.
[6] 林新祝, 吴健宁,张雪芹, 等. 晚孕期阴道B族链球菌定植与新生儿感染的关系[J]. 中华围产医学杂志,2016,19(7):491-496. DOI: 10.3760/cma.j.issn.1007-9408.2016.07.003.
LinXZ, Wu JN, Zhang XQ, et al. Relationship between group BStreptococcus colonization in late pregnancies and neonatal infection[J]. ChinJ Perinat Med, 2016,19(7): 491-496. DOI:10.3760/cma.j.issn.1007-9408.2016.07.003.
[7] Guan X, Mu X, Ji W, et al. Epidemiology ofinvasive group B streptococcal disease in infants from urban area of SouthChina, 2011-2014[J]. BMC Infect Dis, 2018,18(1):14. DOI:10.1186/s12879-017-2811-0.
[8] Schrag SJ, Farley MM, Petit S, et al.Epidemiology of invasive early-onset neonatal sepsis, 2005 to 2014[J].Pediatrics, 2016,138(6): e20162013. DOI: 10.1542/peds.2016-2013.
[9] Escobar GJ, Puopolo KM, Wi S, et al.Stratification of risk of early-onset sepsis in newborns ≥ 34 weeks' gestation[J]. Pediatrics, 2014,133(1):30-36. DOI:10.1542/peds.2013-1689.
[10] Flidel-Rimon O, Galstyan S, Juster-ReicherA, et al. Limitations of the risk factor based approach in early neonatalsepsis evaluations[J]. Acta Paediatr, 2012,101(12):e540-544. DOI: 10.1111/apa.12013.
[11] Goel N, Shrestha S, Smith R, et al.Screening for early onset neonatal sepsis: NICE guidance-based practice versusprojected application of the Kaiser Permanente sepsis risk calculator in the UKpopulation[J]. Arch Dis Child Fetal Neonatal Ed, 2020,105(2):118-122. DOI:10.1136/archdischild-2018-316777.
[12] Benitz WE, Wynn JL, Polin RA. Reappraisalof guidelines for management of neonates with suspected early-onset sepsis[J].J Pediatr, 2015,166(4):1070-1074. DOI: 10.1016/j.jpeds.2014. 12.023.
[13] Mukhopadhyay S, Eichenwald EC, Puopolo KM.Neonatal early-onset sepsis evaluations among well-appearing infants: projectedimpact of changes in CDC GBS guidelines[J]. J Perinatol, 2013,33(3):198-205.DOI: 10.1038/jp.2012.96.
[14] 中国妇幼保健协会新生儿保健专业委员会, 中国医师协会新生儿科医师分会. 产科母婴同室新生儿管理建议[J].中华新生儿科杂志, 2017,32(2):81-85. DOI:10.3760/cma.j.issn.2096- 2932.2017.02.001.
Committeeon Newborn Health Care, Chinese Maternal and Child Health Association, theChinese Neonatologist Association. Recommendations on postnatal care of thenewborn[J]. Chin J Neonatol, 2017,32(2): 81-85. DOI: 10.3760/cma.j.issn.2096-2932.2017.02.001.
[15] Berardi A, Tzialla C, Travan L, et al.Secondary prevention of early-onset sepsis: a less invasive Italian approachfor managing neonates at risk[J]. Ital J Pediatr, 2018,44(1):73. DOI:10.1186/s13052-018-0515-8.
[16] Cantoni L, Ronfani L, Da Riol R, et al.Physical examination instead of laboratory tests for most infants born tomothers colonized with group B Streptococcus: support for the Centers forDisease Control and Prevention's 2010 recommendations[J]. J Pediatr,2013,163(2):568-573. DOI:10.1016/j.jpeds.2013. 01.034.
[17] Berardi A, Fornaciari S, Rossi C, et al.Safety of physical examination alone for managing well-appearing neonates ≥35 weeks' gestation at risk for early-onset sepsis[J]. J MaternFetal Neonatal Med, 2015,28(10):1123-1127. DOI: 10.3109/14767058. 2014.946499.
[18] Jan AI, Ramanathan R, Cayabyab RG.Chorioamnionitis and management of asymptomatic infants ≥35 weeks without empiric antibiotics[J]. 2017,140(1):e20162744. DOI:10.1542/peds. 2016-2744.
[19] Chiruvolu A, Petrey B, Stanzo KC, et al. Aninstitutional approach to the management of asymptomatic chorioamnionitis-exposed infants born ≥35 weeks gestation[J].Pediatr Qual Saf, 2019,4(6):e238. DOI: 10.1097/pq9. 0000000000000238.
[20] Prevention of early-onset neonatal group Bstreptococcal disease: Green-top Guideline No. 36[J]. BJOG, 2017,124(12):e280-e305.DOI:10.1111/1471-0528.14821.
[21] 陈磊, 刘朝晖. 绒毛膜羊膜炎的致病菌及药敏分析[J].中国妇产科临床杂志,2016,17(2):140-143. DOI: 10.13390/j.issn. 1672-1861.2016.02.013.
ChenL, Liu ZH. Pathogenic bacteria and treatment of chorioamnionitis[J]. Chin JClin Obstet Gynecol, 2016,17(2):140-143. DOI: 10.13390/j.issn.1672-1861.2016.02.013.
[22] Tita AT, Andrews WW. Diagnosis andmanagement of clinical chorioamnionitis[J]. Clin Perinatol, 2010,37(2):339-354.DOI: 10.1016/j.clp.2010.02.003.
[23] Jefferies AL. Management of term infants atincreased risk for early-onset bacterial sepsis[J]. Paediatr Child Health,2017,22(4):223-228. DOI: 10.1093/pch/pxx023.
[24] Towers CV, Yates A, Zite N, et al.Incidence of fever in labor and risk of neonatal sepsis[J]. Am J ObstetGynecol, 2017,216(6): 596.e1-596.e5.DOI:10.1016/j.ajog.2017.02.022.
[25] Braun D, Bromberger P, Ho NJ, et al. Lowrate of rerinatal sepsis in term infants of mothers with chorioamnionitis[J].Am J Perinatol, 33(2):143-150. DOI: 10.1055/s-0035-1560045.
[26] Malloy MH. Chorioamnionitis: epidemiologyof newborn management and outcome United States 2008[J]. J Perinatol,2014,34(8):611-615. DOI: 10.1038/jp.2014.81.
[27] Higgins RD, Saade G, Polin RA, et al.Evaluation and management of women and newborns with a maternal diagnosis ofchorioamnionitis: summary of a workshop[J]. Obstet Gynecol,2016,127(3):426-436. DOI: 10.1097/AOG.0000000000001246.
[28] Committee Opinion No. 712: Intrapartummanagement of intraamniotic infection[J]. Obstet Gynecol, 2017,130(2):e95-e101.DOI: 10.1097/AOG.0000000000002236.
[29] Puopolo KM, Draper D, Wi S, et al.Estimating the probability of neonatal early-onset infection on the basis ofmaternal risk factors[J]. Pediatrics, 2011,128(5):e1155-1163. DOI:10.1542/peds.2010-3464.
[30] Kiser C, Nawab U, McKenna K, et al. Role ofguidelines on length of therapy in chorioamnionitis and neonatal sepsis[J].Pediatrics, 2014,133(6):992-998. DOI: 10.1542/peds.2013-2927.
[31] Shakib J, Buchi K, Smith E, et al.Management of newborns born to mothers with chorioamnionitis: is it time for akinder, gentler approach?[J]. Acad Pediatr, 2015,15(3):340-344. DOI:10.1016/j.acap.2014.11.007.
[32] Prevention of group B streptococcalearly-onset disease in newborns: ACOG Committee Opinion, Number 797[J]. ObstetGynecol, 2020,135(2):e51-e72. DOI: 10.1097/AOG. 0000000000003668.
[33] 时春艳, 曲首辉, 杨磊, 等. 妊娠晚期孕妇B族链球菌带菌状况的检测及带菌对妊娠结局的影响[J].中华妇产科杂志,2010,45(1):12-16. DOI: 10.3760/cma.j.issn.0529-567x.2010.01.005.
ShiCY, Qu SH, Yang L, et al. Detection of maternal colonization of group Bstreptococcus in late pregnancy by real-time polymerase chain reaction and itseffect on perinatal outcome[J]. Chin J Obstet Gynecol, 2010,45(1): 12-16. DOI:10.3760/cma.j.issn.0529-567x.2010.01.005.
[34] Lin FY, Weisman LE, Azimi P, et al.Assessment of intrapartum antibiotic prophylaxis for the prevention ofearly-onset group B streptococcal disease[J]. Pediatr Infect Dis J,2011,30(9):759-763. DOI: 10.1097/INF.0b013e31821dc76f.
[35] Prevention of group B streptococcalearly-onset disease in newborns: ACOG Committee Opinion, Number 782[J]. ObstetGynecol, 2019,134(1):1. DOI: 10.1097/AOG.0000000000003334.
[36] 中华医学会妇产科学分会产科学组. 胎膜早破的诊断与处理指南(2015)[J]. 中华妇产科杂志,2015,50(1):3-8. DOI: 10.3760/cma.j.issn.0529-567x.2015.01.002.
ObstetricsSubgroup, Chinese Society of Obstetrics and Gynecology, Chinese MedicalAssociation. Diagnosis and treatment of premature of membrane[J]. Chin J ObstetGynecol,2015,50(1):3-8. DOI: 10.3760/cma.j.issn.0529-567x.2015.01.002.
[37] Yudin MH, van Schalkwyk J, Van Eyk N. No.233-Antibiotic therapy in preterm premature rupture of the membranes[J]. JObstet Gynaecol Can, 2017,39(9):e207-e212. DOI: 10.1016/j.jogc.2017.06.003.
[38] Practice Bulletin No. 171: Management ofpreterm labor[J]. Obstet Gynecol, 2016,128(4):e155-164. DOI: 10.1097/AOG.0000000000001711.
[39] Goel A, Nangia S, Saili A, et al. Role ofprophylactic antibiotics in neonates born through meconium-stained amnioticfluid (MSAF)--a randomized controlled trial[J]. Eur J Pediatr, 2015,174(2):237-243.DOI: 10.1007/s00431-014-2385-4.
[40] Kelly LE, Shivananda S, Murthy P, et al.Antibiotics for neonates born through meconium-stained amniotic fluid[J].Cochrane Database Syst Rev, 2017,6(6):CD006183. DOI:10.1002/14651858.CD006183.pub2.
[41] Siriwachirachai T, Sangkomkamhang US,Lumbiganon P, et al. Antibiotics for meconium-stained amniotic fluid in labourfor preventing maternal and neonatal infections[J]. Cochrane Database Syst Rev,2014,2014(11):CD007772. DOI: 10.1002/14651858.CD007772.pub3.
[42] Mjelle AB, Guthe H, Reigstad H, et al.Serum concentrations of C-reactive protein in healthy term-born Norwegianinfants 48-72 hours after birth[J]. Acta Paediatr, 2019,108(5):849-854. DOI:10.1111/apa.14578.
[43] Perrone S, Lotti F, Longini M, et al. Creactive protein in healthy term newborns during the first 48 hours of life[J].Arch Dis Child Fetal Neonatal Ed, 2018,103(2):F163-F166. DOI:10.1136/archdischild-2016-312506.
[44] 杜立中. 新生儿败血症诊断和预防面临的挑战[J].中华儿科杂志,2019,57(4):241-243. DOI:10.3760/cma.j.issn.0578-1310. 2019.04.001.
DuLZ. Challenges in diagnosis and prevention of neonatal sepsis[J]. Chin JPediatr, 2019,57(4):241-243. DOI:10.3760/cma.j.issn.0578-1310.2019.04.001.
[45] Shane AL, Sánchez PJ, Stoll BJ. Neonatalsepsis[J]. Lancet, 2017,390(10104):1770-1780.DOI:10.1016/S0140-6736(17)31002-4.
[46] Lambert B, Nafday SM, Campbell DE, et al.Utility of intramuscular antibiotics for secondary prevention of early onset,asymptomatic 'suspected' neonatal sepsis[J]. J Perinatol, 2012,32(6):454-459.DOI: 10.1038/jp.2011.126.
[47] Keij FM, Kornelisse RF, Hartwig NG, et al.Oral antibiotics for neonatal infections: a systematic review andmeta-analysis[J]. J Antimicrob Chemother, 2019,74(11):3150-3161. DOI:10.1093/jac/dkz252
来源:中华围产医学杂志
